
����Ŀ������������������Ԫ��,���������������������������Ҫ����,ʵ��С����еⵥ�ʵ��Ʊ���
���������ϣ�����������,I2�ᷢ���绯��Ӧ����I-��IO3-,����������, I-��IO3-�ֻᷢ�����з�Ӧ����I2������ˮ�е��ܽ��Ϊ0.029g��
�������ȡ���Ժ���Ϊԭ��,�������²������ʵ�顣

��1������B�����ķ�Ӧ����������,��һ�����пɹ�ѡ�õ��Լ�: ��Cl2����Br2����ϡ�����H2O2,������Ⱦ�Ƕȿ��ǣ�����Ϊ�����Լ���______�����ţ�,��Ӧ��I-ת��ΪI2 �����ӷ�Ӧ����ʽΪ________��
��2������C��ʹ�õ��������õ�������_______,ʹ�ø�����ʱ,��һ��������_______________��
��3����ͬѧ�����Ϻ���CCl4�ж�,�������Ҵ�����,���жϸ������Ƿ����,ԭ����_______________��
��4������ķ��룩�õ���I2��CCl4��Һ��,������ͼװ�ý��е����ȡ�������ܼ���

ͼ�����������Դ���,�ֱ�����_________����_________��
���𰸡��� 2I-+2H++H2O2=2H2O+I2 ��Һ©�� ��© ���У��Ҵ����ܼ�ˮ���ܣ�����������ȡ��ˮ�еĵⵥ�� �¶ȼ�ˮ�������̫�û����������ƿ��֧�ܴ� ��ȴˮ�����ڽӷ���
��������
��1������B�����ķ�Ӧ����������,��һ�����к����Լ��Ǣ�ϡ�����H2O2,��Ϊ�䷴Ӧ�IJ���Ի�������Ⱦ�����������嶼����Ⱦ��������Ӧ��I-ת��ΪI2 �����ӷ�Ӧ����ʽΪ2I-+2H++H2O2=2H2O+I2 ��
��2������C�Ƿ�Һ��ʹ�õķ��������Ƿ�Һ©��,ʹ�ø�����ʱ,��һ�������Ǽ�©�������ڲ��ͻ��������Ƿ�©ˮ����
��3���������Ҵ�����CCl4,ԭ�������Ҵ���ˮ���ܣ�����������ȡ��ˮ�еĵⵥ�ʡ�
��4��ͼ�����������Դ���,�ֱ��Ǣ��¶ȼ�ˮ�������̫�û����������ƿ��֧�ܴ�������ȴˮ�����ڽӷ��ˡ�


 �����Ļ������������������ϵ�д�
�����Ļ������������������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��PET(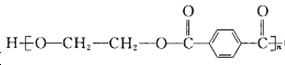 O��CH2CH2OH)������ʳƷ��װ���ϣ���ϳɹ����в��ָ�����������ϳɼ���ϩ��������ϳ�·�����£�
O��CH2CH2OH)������ʳƷ��װ���ϣ���ϳɹ����в��ָ�����������ϳɼ���ϩ��������ϳ�·�����£�
��֪��I.RCOOR��+R����OH ![]() RCOOR�� �� +R�� OH��R��R����R��������������
RCOOR�� �� +R�� OH��R��R����R��������������
II��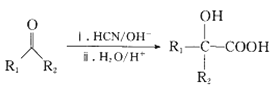 ��R1��R2������
��R1��R2������
III��F�ĺ˴Ź�������ֻ��һ�ַ�
�ش��������⣺
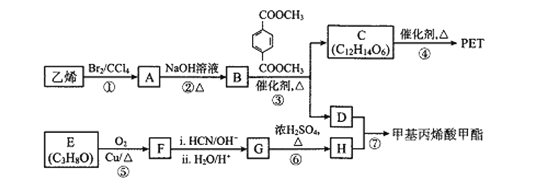
��1��A��ϵͳ����Ϊ_______________��E�й����ŵ�����Ϊ______________��
��2����Ӧ�۵ķ�Ӧ������________���÷�Ӧ������Ҫ���������D����ϻ�ѧ����ѧԭ���������ܵ�ԭ����_______��F�Ľṹ��ʽΪ_______��
��3����Ӧ�ܵĻ�ѧ����ʽΪ_______��
��4����Ӧ�Ļ�ѧ����ʽΪ_______��
��5����д��![]() ������ͬ���칹���У������������������ʵĽṹ��ʽ_________(��д����)��
������ͬ���칹���У������������������ʵĽṹ��ʽ_________(��д����)��
�ٱ����ϵ�һ�ȴ���ֻ������
�ڱ����ϵ�ȡ��������������
�ۺ���ȹ�����ʾ��2 ��-COOH
��6����֪��CH2=CHOH���ȶ���ת��ΪCH3CHO�����������ϳ�·�ߣ������![]() ��CH3OHΪԭ��(���Լ���ѡ)�ϳɾ���ǿ��ˮ�Եĵ���Һ����ϩ��(
��CH3OHΪԭ��(���Լ���ѡ)�ϳɾ���ǿ��ˮ�Եĵ���Һ����ϩ��(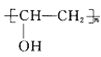 )��·��_______��
)��·��_______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����(����)
A.����������ͨ�����������γɵ�ǿ������ó�Ϊ���Ӽ�
B.�ڢ�A��Ԫ��ԭ�Ӻ͵ڢ�A��Ԫ��ԭ��֮�䶼�γ����Ӽ�
C.����Ԫ����ǽ���Ԫ�ػ���ʱ����һ���γ����Ӽ�
D.ֻ�л��ý���Ԫ������÷ǽ���Ԫ��֮������γ����Ӽ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʵķ����ᴿ��Ҫ�����û�ѧ�������ǣ� ��
A.��ȥ���κ��еĿ���������
B.���ô���������м��ɳ�Ļ����
C.��������ˮ�Ʊ�����ˮ
D.ɳ���Խ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��X��Y��Z��M��W��ԭ��������С�������е����ֶ���������Ԫ�أ�����X��Z��M��W����Ԫ�ص�ԭ������֮��Ϊ32����Ԫ�����ڱ���X��ԭ�Ӱ뾶��С��Ԫ�أ�Yԭ�ӵ�����������������Ӳ�����2����Z��M�������ڣ�M��Wλ��ͬ���塣�ش��������⣺
��1��Y�����ڱ��е�λ����________, W�������ӷ�����_____��
��2��Z�ĵ��ʵĽṹʽΪ________����״���£��Թ����ռ���Z�ļ��⻯�������ˮ�У��������ʲ����Թ�����ɢ����һ��ʱ����Թ�����Һ�����ʵ����ʵ���Ũ��Ϊ_______��
��3����X��Z��M����Ԫ����ɵĻ��������ᡢ��εĻ�ѧʽ�ֱ�Ϊ_________��______________��_____________ ������һ������
��4��д������ʱY�ĵ�����W������������ˮ�����Ũ��Һ������Ӧ�Ļ�ѧ����ʽ��____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NA��ʾ�����ӵ���������ֵ�������ж���ȷ����
A. 25�棬pH��13��NaOH��Һ�к���OH������ĿΪ0.1NA
B. �����£�2.7g������������Ũ��Ϊ18mol��L��1��Ũ���ᷴӦʱת�Ƶĵ�����Ϊ0.3NA
C. 46g�Ҵ��к���C��H������ĿΪ6NA
D. 12.0g ��NaHSO4�������������״̬��������ӵ�������0.2NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ǧ���ص������ֱ�ΪǦ�Ͷ�����Ǧ���������ҺΪ���ᣬ����ʱ�ĵ�ط�ӦΪPb��PbO2��2H2SO4=2PbSO4��2H2O�����н�����ȷ���ǣ� ��
A.ǦΪ����������
B.��Һ��pH���ϼ�С
C.���������ֻ�������Ǧ���ƶ�
D.������Ǧ�����������Ǧ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ֻ������Ԫ����ɵĻ��������һ��Ԫ������Ԫ�أ����������⻯����������������⻯�����( )
A.HCHOB.PH3C.NaHD.HCl
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ǰ������Ԫ��A��B��C��D��E��Fԭ���������ε�������֪��A��B��D��C�ļ۵������������࣬A��B��Cͬ������C�Ǹ������е縺������Ԫ�أ�A�����������ӣ�E��δ�ɶԵ�������ǰ�����������ģ�����۵�������D��ͬ�� F������������Ϊ2���ڲ�ȫ�����������ö�Ӧ��Ԫ�ط��Żش���������⣺
��1��д��E�ļ۵����Ų�ʽ��______________��
��2����A�γɵĻ������У�A��ȡsp2�ӻ����ҷ�������С�Ļ�����Ϊ��д��ѧʽ��______________��
��3���������ʵ�����������йص���______________��
A. ��ȼ�����γ� B. A���⻯��ķе� C. B���⻯������ȶ���
��4��E3+������AB���γ������ӣ�����E3+��d2sp3��ʽ�ӻ����ӻ����ȫ��������AB���γ���λ������E3+����λ��Ϊ______________��1mol���������к���______________mol������
��5��F��D�γɵĻ����ᄃ����ͼ��F����λ��Ϊ______________�������ܶ�Ϊa g/cm3,NAΪ�����ӵ����������߳�Ϊ______________pm����1pm=10-10cm��

�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com