
| A、1molNa2O2固体中含离子总数为4NA | ||||
| B、常温下,5.6gFe与足量稀HNO3反应,转移0.2NA个电子 | ||||
| C、常温常压下,5.6g乙烯与丁烯的混合物中含有的氢原子的数目为0.8NA | ||||
D、5NH4NO3
|
| ||
| ||


科目:高中化学 来源: 题型:
| A、CaO、C2H5OH |
| B、HCl、CH3COOH |
| C、H2S、BaSO4 |
| D、NH3?H2O、Cu |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,22.4LCCl4中含有的分子数目为NA |
| B、16.8g铁粉与足量水蒸气完全反应转移电子数为0.9NA |
| C、已知N2(g)+3H2(g)?2NH3(g);△H=-92.4kJ/mol.当该反应放出184.8kJ热量时,形成N-H键数为12NA |
| D、1mol乙烯和丙烯的混合气体中α键数为5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、醋酸除去水垢中的CaCO3:CaCO3+2H+=Ca2++H2O+CO2↑ |
| B、碘水中通入足量的SO2:I2+SO2+2H2O=2HI+SO42-+2H+ |
| C、NaHSO4溶液与Ba(OH)2溶液反应至中性:H++SO42-+Ba2++OH-=BaSO4↓+H2O |
| D、4 mol?L-1的NaAlO2溶液和7 mol?L-1的盐酸溶液等体积混合均匀4AlO2-+7H++H2O=3A1(OH)3↓+Al3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氯气通入水中:Cl2+H2O?2H++Cl-+ClO- |
| B、氢氧化铁胶体中加入HI溶液:Fe(OH)3+3H+=Fe3++3H2O |
| C、NaAlO2溶液中通入过量CO2:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32- |
| D、用稀硝酸除去试管内壁银:3Ag+4H++NO3-=3Ag++NO↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 浓硫酸 |
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
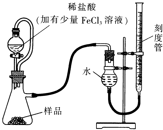 镁(MgO2)易溶于稀酸,溶于酸后会产生过氧化氢,在医学上可作为“解酸剂”等.过氧化镁产品中常会混有一定量的MgO,实验室可通过多种方案测定样品中过氧化镁的含量.某研究小组拟用如图装置测定一定质量的样品中过氧化镁的含量.
镁(MgO2)易溶于稀酸,溶于酸后会产生过氧化氢,在医学上可作为“解酸剂”等.过氧化镁产品中常会混有一定量的MgO,实验室可通过多种方案测定样品中过氧化镁的含量.某研究小组拟用如图装置测定一定质量的样品中过氧化镁的含量.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com