
已知反应X+Y===M+N为放热反应,对该反应的下列说法中正确的是( )
A.X的焓一定高于M
B.Y的焓一定高于N
C X和Y的总焓一定高于M和N的总焓
D.因为该反应为放热反应,故不必加热反应就可发生
 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案科目:高中化学 来源: 题型:
某溶液可能含有下列离子中的几种(不考虑溶液中微量的H+和OH-):Na+、NH 、SO
、SO 、CO
、CO 、NO
、NO 。取200 mL该溶液,等体积分成两份,分别做下列实验。
。取200 mL该溶液,等体积分成两份,分别做下列实验。
实验一:第一份加入足量烧碱并加热,产生的气体在标准状况下为224 mL。
实验二:第二份先加入足量的盐酸,无现象,再加入足量BaCl2溶液,得沉淀2.33 g。
下列说法正确的是( )
A.该溶液可能含有Na+
B.该溶液一定含有NH 、SO
、SO 、CO
、CO 、NO
、NO
C.该溶液一定不含有NO
D.该溶液一定含有Na+,且c(Na+)≥0.1 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
已知1 mol红磷转化为1 mol白磷,吸收18.39 kJ热量。
①4P(红,s)+5O2(g)===2P2O5(s);ΔH1
②P4(白,s)+5O2(g)===2P2O5(s);ΔH2
则ΔH1与ΔH2的关系正确的是( )
A.ΔH1=ΔH2 B.ΔH1>ΔH2
C.ΔH1<ΔH2 D.无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
已知中和热的数值是57.3 kJ·mol–1。下列物质反应时,产生57.3 kJ热量的是( )
A.稀HCl和稀NaOH
B.1.0 mol·L–1 HCl和1.0 mol·L –1 NaOH
C.500 mL 2.0 mol·L-1 HCl和500 mL2.0 mol·L –1 NaOH
D.500 mL 2.0 mol·L–1 H2SO4和500 mL 2.0 mol·L–1 Ba(OH)2
查看答案和解析>>
科目:高中化学 来源: 题型:
有A、B、C、D 4种短周期元素,它们的核电荷数依次增大。在元素周期表中,A原子半径最小,A与C是同主族元素,B与D也是同主族元素,B、D两元素的原子序数之和是A、C两元素的原子序数之和的两倍,D元素的单质是淡黄色固体。
(1)B、C、D原子半径由大到小的顺序为 。(填元素符号)
(2)写出化合物A2B电子式: 。
(3)电子式表示化合物 C2D 的形成过程: 。
(4)元素周期表位于对角线的两种元素其性质相似称之为对角线规则。根据周期表对角
线规律,金属Be单质及其化合物的性质与铝单质及其化合物的性质相似。
①写出Be与C的最高价氧化物对应的水化物溶液反应的化学方程式 。
②鉴别Be(OH)2和Mg(OH)2可选用的试剂为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
右图是关于反应A2(g)+3B2(g) 2C(g)(正反应为放热反应)的平衡移动图象,影响平衡移动的原因可能是( )
2C(g)(正反应为放热反应)的平衡移动图象,影响平衡移动的原因可能是( )
A.升高温度,同时加压
B.降低温度,同时减压
C.增大反应物浓度,同时减小生成物浓度
D.增大反应物浓度,同时使用催化剂

查看答案和解析>>
科目:高中化学 来源: 题型:
下图表示反应X(g) 4Y(g)+Z(g),ΔH<0,在某温度时X的浓度随时间变化的曲线:
4Y(g)+Z(g),ΔH<0,在某温度时X的浓度随时间变化的曲线:
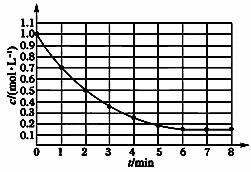
下列有关该反应的描述正确的是( )
A.第6min后,反应就终止了
B.X的平衡转化率为85%
C.若升高温度,X的平衡转化率将大于85%
D.若降低温度,v正和v逆将以同样倍数减小
查看答案和解析>>
科目:高中化学 来源: 题型:
有a、b、c、d四个金属电极,有关的反应装置及部分现象如下:

由此可判断这四种金属的活动性顺序是 ( )
A.a>b>c>d B.b>c>d>a C.d>a>b>c D. a>b>d>c
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com