
下列有关化学研究的正确说法是
A.同时改变两个变量来研究反映速率的变化,能更快得出有关规律
B.对于同一个化学反应,无论是一步完成还是分几步完成,其反应的焓变相同
C.依据丁达尔现象可将分散系分为溶液、胶体与浊液
D.从HF、HCl、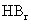 、HI酸性递增的事
、HI酸性递增的事 实,推出F、Cl、Br、I的非金属递增的规律
实,推出F、Cl、Br、I的非金属递增的规律
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
用纯净的碳酸钙跟稀盐酸反应制取二氧化碳气体。请回答问题:
 (1)实验过程如右图所示,分析判断:
(1)实验过程如右图所示,分析判断:
段(选:OE或EF或FG)化学反应速率最大。
(2)为了减缓上述化学反应的速率,欲向溶液中加入下列物质,你认为可行的是 。
A.蒸馏水 B.NaCl固体 C.NaCl溶液 D.浓盐酸
(3)除了上述方法外,你认为还可以采取哪些措施来减缓化学反应速率_______________________(填一种即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于食物酸碱性的说法正确的是( )
A.食物本身具有酸味,即为酸性食物
B.蔬菜、水果等均属于酸性食物
C.蛋白质中含N、P、S等元素,其中氮元素最终变成硝酸
D.在人体代谢后最终生成碱性物质的食物,称为碱性食物
查看答案和解析>>
科目:高中化学 来源: 题型:
中学化学中很多“规律”都有其使用范围,下列根据有关“规律”推出的结论合理的是
A.根据同周期元素的第一电离能变化趋势,推出Al的第一电离能比Mg大
B.根据主族元素最高正化合价与族序数的关系,推出卤族元素最高正价都是+7
C.根据溶液的pH与溶液酸碱性的关系,推出pH=6.8的溶液一定显酸性
D.根据较强酸可以制取较弱酸的规律,推出CO2通入NaClO溶液中能生成HClO
查看答案和解析>>
科目:高中化学 来源: 题型:
铜是重要金属,Cu的化合物在科学研究和工业生产中具有许多用途,如CuSO4溶液常用作电解液、电镀液等。请回答以下问题:
(1)CuSO4可由金属铜与浓硫酸反应制备,该反应的化学方程式为___________;
(2)CuSO4粉末常用来检验一些有机物中的微量水分,其原因是_______;
(3)SO42-的立体构型是________,其中S原子的杂化轨道类型是_______;
(4)元素金(Au)处于周期表中的第六周期,与Cu同族,A u原子最外层电子排布式为______;一种铜合金晶体具有立方最密堆积的结构,在晶胞中Cu原子处于面心,Au原子处于顶点位置,则该合金中Cu原子与Au原子数量之比为_______;该晶体中,原子之间的作用力是________;
u原子最外层电子排布式为______;一种铜合金晶体具有立方最密堆积的结构,在晶胞中Cu原子处于面心,Au原子处于顶点位置,则该合金中Cu原子与Au原子数量之比为_______;该晶体中,原子之间的作用力是________;
(5)上述晶体具有储氢功能,氢原子可进入到由Cu原子与Au原子构成的四面体空隙中。若将Cu原子与Au原子等同看待,该晶体储氢后的晶胞结构为CaF2的结构相似,该晶体储氢后的化学式应为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z、W是元素周期表前四周期中的四种常见元素,其相关信息如下表:
| 元素 | 相关信息 |
| X | X的基态原子核外3个能级上有电子,且每个能级上的电子数相等 |
| Y | 常温常压下,Y单质是淡黄色固体,常在火山口附近沉积 |
| Z | Z和Y同周期,Z的电负性大于Y |
| W | W的一种核素的质量数为63,中子数为34 |
(1)Y位于元素周期表第 周期表 族,Y和Z的最高价氧化物对应的水化物的酸性较强的是 (写化学式)。
(2)XY2是一种常用的溶剂,XY2的分子中存在 个σ键。在H―Y、H―Z两种共价键中,键的极性较强的是 ,键长较长的是 。
(3)W的基态原子核外电子排布式是 。W2Y在空气中煅烧生成W2O的化学方程式是 。
(4)处理含XO、YO2烟道气污染的一种方法,是将其在催化剂作用下转化为单质Y。
已知:
XO(g)+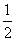 O2(g)=XO2(g)
O2(g)=XO2(g)  H=-283.0 kJ·mol-2
H=-283.0 kJ·mol-2
Y(g)+ O2(g)=YO2(g)  H=-296.0 kJ·mol-1
H=-296.0 kJ·mol-1
此反应的热化学方程式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
元素X、Y、Z原子序数之和为36,X、Y在同一周期,X+与Z2-具有相同的核外电子层结构。下列推测不正确的是( )
A.同周期元素中X的金属性最强
B.原子半径X>Y,离子半径X+>Z2-
C.同族元素中Z的氢化物稳定性最高
D.同周期元素中Y的最高价含氧酸的酸性最强
查看答案和解析>>
科目:高中化学 来源: 题型:
下表是元素周期表的一部分,有关说法正确的是( )
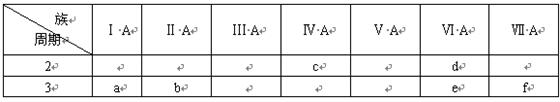
A.e的氢化物比d的氢化物稳定
B.a、b、e三种元素的原子半径:e>b>a
C.六种元素中,c元素单质的化学性质最活泼
D.c、e、f的最高价氧化物对应的水化物的酸性依次增强
查看答案和解析>>
科目:高中化学 来源: 题型:
A题适用于二期课改新教材,B题适用于一期课改教材。
(A)

(1)在上面元素周期表中画出金属元素与非金属元素的分界线。
(2)根据NaH的存在,有人提议可把氢元素放在VIIA族,那么根据其最高正价与最低负价的绝对值相等,又可把氢元素放在周期表中的 族。
(3)现有甲、乙两种元素,甲元素原子核外3p亚层上有5个电子,乙元素的焰色反应显黄色。
① 用元素符号将甲、乙两元素填写在上面元素周期表中对应位置。
② 甲元素与硫元素相比较,非金属性较强的是 (填名称),
写出可以验证该结论的一个化学反应方程式
(B)
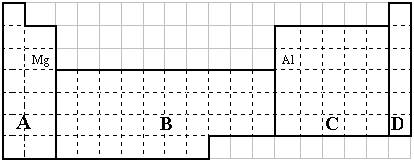
(1)在上面元素周期表中全部是金属元素的区域为
(a) A (b) B (c) C (d) D
(2)有人认为形成化合物最多的元素不是IVA族的碳元素,而是另一种短周期元素,请你根据学过的化学知识判断这一元素是 。
(3)现有甲、乙两种短周期元素,室温下,甲元素单质在冷的浓硫酸或空气中,表面都生成致密的氧化膜,乙元素原子核外M电子层与K电子层上的电子数相等。
① 用元素符号将甲、乙两元素填写在上面元素周期表中对应的位置。
② 甲、乙两元素相比较,金属性较强的是 (填名称),可以验证该结论的实验是 。
(a)将在空气中放置已久的这两种元素的块状单质分别放入热水中
(b)将这两种元素的单质粉末分别和同浓度的盐酸反应
(c)将这两种元素的单质粉末分别和热水作用,并滴入酚酞溶液
(d)比较这两种元素的气态氢化物的稳定性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com