
A题适用于二期课改新教材,B题适用于一期课改教材。
(A)

(1)在上面元素周期表中画出金属元素与非金属元素的分界线。
(2)根据NaH的存在,有人提议可把氢元素放在VIIA族,那么根据其最高正价与最低负价的绝对值相等,又可把氢元素放在周期表中的 族。
(3)现有甲、乙两种元素,甲元素原子核外3p亚层上有5个电子,乙元素的焰色反应显黄色。
① 用元素符号将甲、乙两元素填写在上面元素周期表中对应位置。
② 甲元素与硫元素相比较,非金属性较强的是 (填名称),
写出可以验证该结论的一个化学反应方程式
(B)
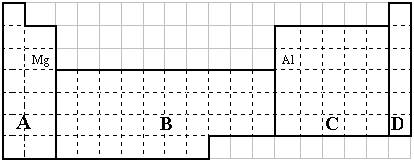
(1)在上面元素周期表中全部是金属元素的区域为
(a) A (b) B (c) C (d) D
(2)有人认为形成化合物最多的元素不是IVA族的碳元素,而是另一种短周期元素,请你根据学过的化学知识判断这一元素是 。
(3)现有甲、乙两种短周期元素,室温下,甲元素单质在冷的浓硫酸或空气中,表面都生成致密的氧化膜,乙元素原子核外M电子层与K电子层上的电子数相等。
① 用元素符号将甲、乙两元素填写在上面元素周期表中对应的位置。
② 甲、乙两元素相比较,金属性较强的是 (填名称),可以验证该结论的实验是 。
(a)将在空气中放置已久的这两种元素的块状单质分别放入热水中
(b)将这两种元素的单质粉末分别和同浓度的盐酸反应
(c)将这两种元素的单质粉末分别和热水作用,并滴入酚酞溶液
(d)比较这两种元素的气态氢化物的稳定性
【答案】
(A)
(1)见表中
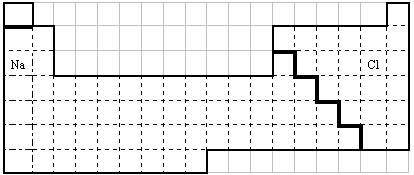
(2)IVA
(3)① 见表
② 氯 H2S + Cl2 → 2HCl + S↓
【解析】本题综合考查元素周期表与元素周期律的相关知识。(1)金属与非金属的分界线除第ⅠA在氢元素下侧外,其他各族元素皆处于周期数主族数的元素的上侧和右侧。(2)在周期表中只有第ⅣA的元素的最高正价与最低负价的绝对值相等。(3)甲元素的核外电子排布为:1s22s22p63s23p5,即甲元素为氯;乙元素焰色反应呈黄色,则乙元素为钠元素;硫、氯处于同一周期,氯位于硫的右侧,比硫的非金属性强,可由反应Cl2+H2S====S↓+2HCl来证明上述结论。
(B)
(1)b
(2)H
(3)① 见表

② 镁 b、c
【解析】(1)在元素周期表的分区中,只有副族及第Ⅷ族的元素全部为金属,故本题答案为b。
(2)碳元素形成化合物种类最多的原因,是碳碳之间可形成长链及同分异构现象,即可形成众多的有机物,而绝大部分的有机物都含氢元素,故这种除碳外的短周期元素应是氢元素。
(3)可 与冷浓H2SO4作用形成致密的氧化膜的单质为铁和铝,而铁不是短周期元素,故甲为铝,由题意知乙元素原子的核外电子排布为
与冷浓H2SO4作用形成致密的氧化膜的单质为铁和铝,而铁不是短周期元素,故甲为铝,由题意知乙元素原子的核外电子排布为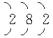 ,即乙为镁元素,镁、铝同周期,镁在铝的左侧,镁的金属性比铝强,从两者与H2O或酸反应的难易,Mg(OH)2、Al(OH)3的酸碱性强弱比较得之。
,即乙为镁元素,镁、铝同周期,镁在铝的左侧,镁的金属性比铝强,从两者与H2O或酸反应的难易,Mg(OH)2、Al(OH)3的酸碱性强弱比较得之。


 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案科目:高中化学 来源: 题型:
下列有关化学研究的正确说法是
A.同时改变两个变量来研究反映速率的变化,能更快得出有关规律
B.对于同一个化学反应,无论是一步完成还是分几步完成,其反应的焓变相同
C.依据丁达尔现象可将分散系分为溶液、胶体与浊液
D.从HF、HCl、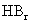 、HI酸性递增的事
、HI酸性递增的事 实,推出F、Cl、Br、I的非金属递增的规律
实,推出F、Cl、Br、I的非金属递增的规律
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y为短周期元素,X位于IA族,X与Y可形成化合物X2Y,下列说法正确的是
A.X的原子半径一定大于Y的原子半径
B.X与Y的简单离子不可能具有相同的电子层结构
C.两元素形成的化合物中,原子个数比不可能为1:1
D.X2Y可能是离子化合物,也可能是共价化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
已知1—18号元素的离子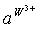 、
、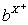 、
、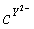 、
、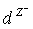 都具有相同的电子层结构,下列关系正确的是
都具有相同的电子层结构,下列关系正确的是
A.质子数c>b
B.离子的还原性Y2->Z-
C.氢化物的稳定性H2Y>HZ
D.原子半径X<W
查看答案和解析>>
科目:高中化学 来源: 题型:
甲、乙、丙、丁为前三周期元素形成的微粒,它们的电子总数相等。已知甲、乙、丙为双原子分子或负二价双原子阴离子,丁为原子。
(1)丙与钙离子组成的离子化合物跟水反应产生一种可燃性气体,反应的化学程式是
(2)乙在高温时是一种还原剂,请用化学方程式表示它在工业上的一种重要用途:
(3)在一定条件下,甲与O2反应的化学方程式是
(4)丁的元素符号是 ,它的原子结构示意图为
(5)丁的氧化物的晶体结构与 的晶体结构相似。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知1~18号元素的离子,aW3+、bX+、cY2-、dZ-都具有相同的电子层结构,下列关系正确的是
A.质子数c>d
B.离子的还原性Y2->Z-
C.氢化物的稳定性H2Y>HZ
D.原子半径X<W
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关说法正确的是
A.C、N、O三种元素第一电离能从大到小的顺序是O>N>C
B.根据同周期元素的第一电离能变化趋势,推出Al的第一电离能比Mg大
C.根据主族元素最高正化合价与族序数的关系,推出卤族元素最高正价都是+7
D.Ni原子的核外电子排布式为1s22s23s23p63d84s2
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法不正确的是( )
①最外层电子数是2的元素一定是金属元素
②元素周期表中,非金属性最强的元素是F
③盐酸是强酸,H2S是弱酸,故非金属性:Cl>S
④X元素的阳离子和Y元素的阴离子具有相同的电子层结构,则原子序数:X>Y
⑤O2和O3属于同素异形体,故它们的性质相同
⑥H2O稳定的原因是水分子间存在氢键
A.①④⑥ B.①③⑤ C.①③⑤⑥ D.③⑤⑥
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com