
| A、需要加热才能发生的反应一定是吸热反应 |
| B、中和反应都是放热反应 |
| C、放热反应的反应速率总是大于吸热反应的反应速率 |
| D、同温同压下,反应H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的△H不同 |


科目:高中化学 来源: 题型:
| A、氯气通入氢氧化钠溶液中:[Na+]=[Cl-]+[ClO-]+[OH-] |
| B、pH=8.3的NaHCO3溶液:[Na+]>[HCO3-]>[CO32-]>[H2CO3] |
| C、pH=11的氨水与pH=3的盐酸等体积混合:[Cl-]=[NH4+]>[OH-]=[H+] |
| D、某溶液中只存在SO42-、OH-、NH4+、H+四种离子,则可能存在:[NH4+]>[SO42-]>[H+]>[OH-] |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- | ||
| 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
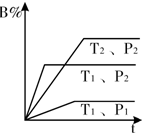 已知某可逆反应mA(g)+n B(g)?pC(g)△Η=Q在密闭容器中进行,如图中表示在不同反应时间t时,温度T和压强P与反应物B在混合气体中的百分含量B%的关系曲线,由曲线分析下列判断正确的( )
已知某可逆反应mA(g)+n B(g)?pC(g)△Η=Q在密闭容器中进行,如图中表示在不同反应时间t时,温度T和压强P与反应物B在混合气体中的百分含量B%的关系曲线,由曲线分析下列判断正确的( )| A、T1<T2 P1>P2 m+n>p Q<0 |
| B、T1>T2 P1<P2 m+n>p Q<0 |
| C、T1<T2 P1>P2 m+n<p Q>0 |
| D、T1>T2 P1<P2 m+n<p Q>0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①④⑤⑦ | B、②⑤⑥⑦ |
| C、①③⑤⑥ | D、①③⑤⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:
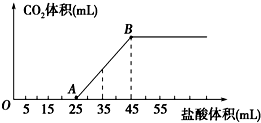
| A、OA段发生反应的离子方程式为:H++OH-═H2O CO32-+H+═HCO3- |
| B、当加入35mL盐酸时,产生CO2的体积为224mL |
| C、A点溶液中的溶质为NaC1、NaHCO3 |
| D、混合物中NaOH的质量0.60g |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、含有食品添加剂的食物对人体健康均有害 |
| B、普通玻璃和氮化硅陶瓷都属于新型无机非金属材料 |
| C、大力推广应用燃料“脱硫、脱硝”技术,可减少硫氧化物和氮氧化物对空气的污染 |
| D、为消除碘缺乏病,政府规定在食盐中必须添加一定量的KI |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com