
| A、氯气通入氢氧化钠溶液中:[Na+]=[Cl-]+[ClO-]+[OH-] |
| B、pH=8.3的NaHCO3溶液:[Na+]>[HCO3-]>[CO32-]>[H2CO3] |
| C、pH=11的氨水与pH=3的盐酸等体积混合:[Cl-]=[NH4+]>[OH-]=[H+] |
| D、某溶液中只存在SO42-、OH-、NH4+、H+四种离子,则可能存在:[NH4+]>[SO42-]>[H+]>[OH-] |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| A、四份溶液中水的电离程度由大到小的顺序为:①=②=④<③ |
| B、若将②、③等体积混合,则混合液的pH为7 |
| C、将四份溶液稀释相同倍数后,溶液的pH:③>④>②>① |
| D、若在10mL①中加入④至pH刚好等于7,则C(Na+)=C(CH3COO-),混合溶液总体积<20mL(假设混和溶液体积为酸和碱溶液体积之和) |
查看答案和解析>>
科目:高中化学 来源: 题型:
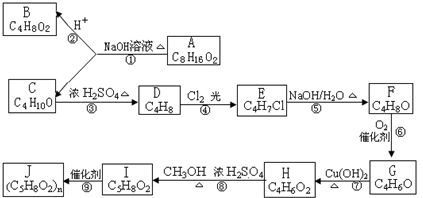
查看答案和解析>>
科目:高中化学 来源: 题型:
A、(
| ||||
| B、(2b-a) mol/L | ||||
C、(5b-
| ||||
| D、(10b-5a) mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| X | Y | Z | |
| A | FeCl2溶液 | FeCl3 | KSCN溶液 |
| B | Fe粉 | A1粉 | NaOH溶液 |
| C | Fe2(SO4)3溶液 | FeSO4 | C12 |
| D | FeCl3溶液 | CuCl2 | Fe粉 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
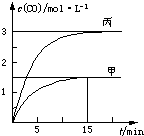 示.下列说法正确的是( )
示.下列说法正确的是( )| 容器 | 甲 | 乙 | 丙 |
| 容积 | 0.5 L | 0.5 L | V |
| 温度 | T1℃ | T2℃ | T1℃ |
| 起始量 | 2 molC 1 molH2O | 1 molCO 1 molH2 | 4 molC 2 molH2O |
| A、甲容器中,反应在前15 min的平均速率v(H2)=0.1 mol?L-1?min-1 |
| B、丙容器的体积V>0.5L |
| C、当温度为T1℃时,反应的平衡常数K=2.25 |
| D、乙容器中,若平衡时n(H2O)=0.4 mol,则T1<T2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| CO? | H? | CH?OH | H?O |
| 0.7mol?L-1 | 0.5mol?L-1 | 0.3mol?L-1 | 0.3mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、需要加热才能发生的反应一定是吸热反应 |
| B、中和反应都是放热反应 |
| C、放热反应的反应速率总是大于吸热反应的反应速率 |
| D、同温同压下,反应H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的△H不同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com