
| CO? | H? | CH?OH | H?O |
| 0.7mol?L-1 | 0.5mol?L-1 | 0.3mol?L-1 | 0.3mol?L-1 |
| c(H2O)c(CH3OH) |
| c(CO2)c3(H2) |
| c(H2O)c(CH3OH) |
| c(CO2)c3(H2) |
| 0.3×0.3 |
| 0.7×0.53 |
| c(H2O)c(CH3OH) |
| c(CO2)c3(H2) |


科目:高中化学 来源: 题型:
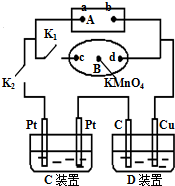 (1)如图所示,A为电源,B为浸透饱和食盐水和酚酞试液的滤纸,滤纸中央滴有一滴KMnO4溶液,C、D为电解槽,其电极材料见图,电解质溶液见已知.
(1)如图所示,A为电源,B为浸透饱和食盐水和酚酞试液的滤纸,滤纸中央滴有一滴KMnO4溶液,C、D为电解槽,其电极材料见图,电解质溶液见已知.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氯气通入氢氧化钠溶液中:[Na+]=[Cl-]+[ClO-]+[OH-] |
| B、pH=8.3的NaHCO3溶液:[Na+]>[HCO3-]>[CO32-]>[H2CO3] |
| C、pH=11的氨水与pH=3的盐酸等体积混合:[Cl-]=[NH4+]>[OH-]=[H+] |
| D、某溶液中只存在SO42-、OH-、NH4+、H+四种离子,则可能存在:[NH4+]>[SO42-]>[H+]>[OH-] |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、分子式为C3H8与C6H14的两种有机物一定互为同系物 |
| B、对有机物分子红外光谱图的研究有助于确定有机物分子中的基团 |
| C、分子式C4H10表示的物质必是纯净物 |
D、有机物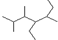 的名称:2,3,5-三甲基-4-乙基庚烷 的名称:2,3,5-三甲基-4-乙基庚烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- | ||
| 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①④⑤⑦ | B、②⑤⑥⑦ |
| C、①③⑤⑥ | D、①③⑤⑦ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com