
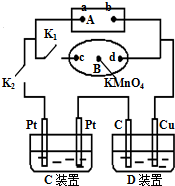
 ��1����ͼ��ʾ��AΪ��Դ��BΪ������ʳ��ˮ�ͷ�̪��Һ����ֽ����ֽ�������һ��KMnO4��Һ��C��DΪ���ۣ���缫���ϼ�ͼ���������Һ����֪��
��1����ͼ��ʾ��AΪ��Դ��BΪ������ʳ��ˮ�ͷ�̪��Һ����ֽ����ֽ�������һ��KMnO4��Һ��C��DΪ���ۣ���缫���ϼ�ͼ���������Һ����֪��
| ||
| ||
| 0.56L |
| 22.4L/mol |
| ||


 Ӧ�����������Ĵ���ѧ������ϵ�д�
Ӧ�����������Ĵ���ѧ������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��������Ksp��Ag2CrO4��=1.1��10-12��Ksp��AgCl��=1.8��10-10����Ag2CrO4���ܽ��С��AgCl |
| B������������ˮ�У�ȥ����Ч����ǿ��˵�������ˮ���Ƿ��ȷ�Ӧ |
| C��Ϊ�������ֵĴ��ǣ����ڴ���������п�� |
| D��������Al2O3Ϊ����ʽ��е��ұ��������������Al3+�������ƶ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A���� | B������ | C������ | D��ʮ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A���ķ���Һ��ˮ�ĵ���̶��ɴ�С��˳��Ϊ����=��=�ܣ��� |
| B�������ڡ��۵������ϣ�����Һ��pHΪ7 |
| C�����ķ���Һϡ����ͬ��������Һ��pH���ۣ��ܣ��ڣ��� |
| D������10mL���м������pH�պõ���7����C��Na+��=C��CH3COO-���������Һ�������20mL����������Һ���Ϊ��ͼ���Һ���֮�ͣ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ��ʼ������pH | ��ȫ������pH | |
| Fe��OH��2 | 7.0 | 9.0 |
| Fe��OH��3 | 1.9 | 3.2 |
| Cr��OH��3 | 6.0 | 8.0 |
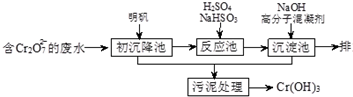
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A���٢� | B���ڢ� | C���ۢ� | D��ֻ�Т� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��Na |
| B��CaCO3 |
| C��BaCl2 |
| D��NaHSO4 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
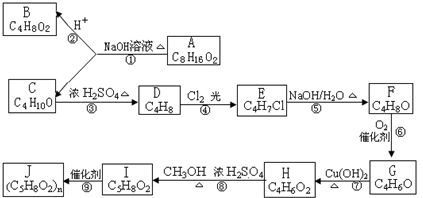
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| CO? | H? | CH?OH | H?O |
| 0.7mol?L-1 | 0.5mol?L-1 | 0.3mol?L-1 | 0.3mol?L-1 |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com