
【题目】实验室制取乙烯,常因温度过高而使乙醇和浓硫酸反应生成少量的二氧化硫。有人设计下列实验以确认反应混合气体中含有乙烯和二氧化硫,装置如图所示,试回答下列问题。

(1)图中①②③④装置可盛放的试剂分别是___________________(填序号,下同)、___________________、___________________、___________________。
A.品红溶液 B.![]() 溶液 C.浓硫酸 D.酸性
溶液 C.浓硫酸 D.酸性![]() 溶液
溶液
(2)能说明二氧化硫气体存在的现象是______________________________________。
(3)使用装置②的目的是________________________,使用装置③的目的是________________________。
(4)能说明混合气体中含有乙烯的现象是____________________________________________________。
【答案】A B A D ①中品红溶液褪色 除去SO2气体 检验SO2气体是否除尽 ③中品红溶液不褪色,④中酸性KMnO4溶液褪色
【解析】
实验目的为确认反应混合气体中含有乙烯和二氧化硫,二氧化硫和乙烯都能使溴水和酸性高锰酸钾褪色,所以要避免相互影响,可先用品红溶液检验二氧化硫,然后用氢氧化钠溶液吸收二氧化硫,再用品红检验二氧化硫是否完全除尽,之后用酸性高锰酸钾或溴水检验乙烯。
(1)装置①中盛有品红溶液,用来检验二氧化硫的存在;然后将气体通入盛有氢氧化钠溶液的②除去二氧化硫,再通入盛有品红溶液的③确定二氧化硫是否除干净,最后通入盛有酸性高锰酸钾的④检验乙烯的存在,盛放的药品依次为A、B、A、D;
(2)二氧化硫具有漂白性,能够使品红溶液褪色,所以①中品红溶液褪色说明含有二氧化硫;
(3)装置②用来除去SO2气体,以免干扰对乙烯的检验;装置③检验SO2是否被除尽;
(4)装置③中的品红溶液不褪色可以排除二氧化硫的干扰,若装置④中的酸性KMnO4溶液褪色,可证明乙烯的存在。


 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案科目:高中化学 来源: 题型:
【题目】如图是模拟石油深加工来合成丙烯酸乙酯等物质的过程,请回答下列问题:
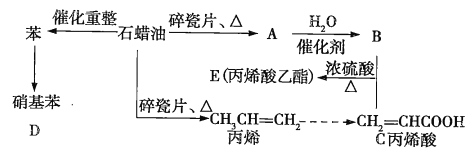
(1)A的结构简式为__________________。
(2)写出B+C→E的化学方程式:____________________________________,反应类型为__________________。
(3)在催化剂条件下,由丙烯酸还可生成聚丙烯酸塑料,写出该反应的化学方程式:______________________________,反应类型为______________________________。
(4)写出由苯生成硝基苯的化学方程式:______________________________,反应类型为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、M、R、W均为周期表中前四周期的元素.X的基态原子外围电子排布式为3s2;Y原子的L电子层的p能级上有一个空轨道;Z元素的基态原子最外层有3个未成对电子,次外层有2个电子;M的原子的2p轨道上有1个电子的自旋方向与其它电子的自旋方向相反;R是海水中除氢、氧元素外含量最多的元素;W为过渡元素,它的基态原子外围电子排布成对电子数和未成对电子数相同且为最外层电子数的两倍.回答下列问题(相关回答均用元素符号表示):
(1)W的基态原子的外围电子排布图为__,其基态原子有__种能量不同的电子。
(2)R的氢化物的沸点比其上一周期同族元素氢化物的沸点低的原因是__。
(3)ZM3-空间构型为___,其中Z的杂化方式为__。
(4)W与YM易形成配合物W(YM)5,在W(YM)5中W的化合价为___;与YM分子互为等电子体的离子的化学式为___。
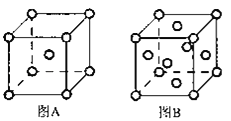
(5)W单质的晶体在不同温度下有两种原子堆积方式,晶胞分别如图A、B所示:图B中原子堆积方式为___,A、B中W原子的配位数之比为___。A、B晶胞的棱长分别为acm和bcm,则A、B两种晶体的密度之比为___。
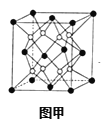
(6)X和W组成的合金是目前已发现的储氢密度最高的储氢材料之一,其晶胞结构如图甲(黑球代表W,白球代表X).则该合金的化学式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)常温下0.1 mol·L-1的CH3COOH溶液在加水稀释过程中,下列表达式的数据一定变小的是________(填字母序号,下同)。
A.c(H+) B.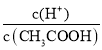 C.c(H+)·c(OH-) D.
C.c(H+)·c(OH-) D.![]()
若该溶液升高温度,上述4种表达式的数据增大的是________。
(2)某温度时,0.1 mol·L-1的醋酸溶液中的c(H+)与0.01 mol·L-1的醋酸溶液中的c(H+)的比值______(填“大于”“小于”或“等于”)10。
(3)已知:25 ℃时,醋酸的电离平衡常数为1.75×10-5。
①求该温度时,a mol·L-1的醋酸溶液中c1(H+)=________mol·L-1(用含a的代数式表示)。[提示:此时a比较小,进行简化计算,平衡时c(CH3COOH)可用初始浓度代替,水电离出的c(H+)、c(OH-)忽略不计,下同]
②若该温度时向该溶液中加入一定量的CH3COONH4(假设溶液体积不变),使溶液中c(CH3COO-)变为b mol·L-1,则此时c2(H+)=________(用含a、b的代数式表示)mol·L-1。
③c1(H+)________(填“大于”“小于”或“等于”)c2(H+)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】t ℃时,AgBr在水中的沉淀溶解平衡曲线如图所示。又知t ℃时AgCl的Ksp=4×10-10,下列说法不正确的是
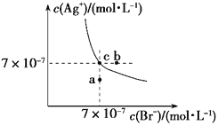
A. 在t ℃时,AgBr的Ksp为4.9×10-13
B. 通过蒸发,可使溶液由a点变到c点
C. 图中b点有AgBr沉淀析出
D. 在t ℃时,AgCl(s)+Br-(aq) ![]() AgBr(s)+Cl-(aq)的平衡常数K≈816
AgBr(s)+Cl-(aq)的平衡常数K≈816
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图装置研究电化学原理,下列分析中错误的是
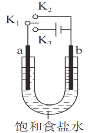
选项 | 连接 | 电极材料 | 分析 | |
a | b | |||
A | K1K2 | 石墨 | 铁 | 模拟铁的吸氧腐蚀 |
B | K1K2 | 锌 | 铁 | 模拟钢铁防护中牺牲阳极的阴极保护法 |
C | K1K3 | 石墨 | 铁 | 模拟电解饱和食盐水 |
D | K1K3 | 铁 | 石墨 | 模拟钢铁防护中外加电流的阴极保护法 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某微生物电池在运行时可同时实现净化有机物污水、净化含 Cr2O72-废水( pH 约为 6)和淡化食盐水,其装置示意图如图所示。图中 D 和 E 为阳离子交换膜或阴离子交换膜,Z 为 待淡化食盐水。已知 Cr3+ 完全沉淀所需的 pH 为 5.6。下列说法不正确的是
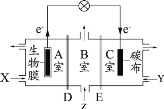
A.C室的电极反应式为 ![]() +6e+8H+=2Cr(OH)3 ↓ + H2O
+6e+8H+=2Cr(OH)3 ↓ + H2O
B.X为有机物污水,Y为含![]() 废水
废水
C.理论上处理 1mol![]() 废水的同时可脱除 6mol的NaCl
废水的同时可脱除 6mol的NaCl
D.E为阴离子交换膜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)赤水晒醋是我们遵义特产之一,其中含有一定量的CH3COOH。写出CH3COOH的电离方程式 ______;在已达平衡的乙酸溶液中加入一定的CH3COONa ,该溶液pH_______(填“增大”“减小”或“不变”)。
(2)燃料电池汽车,尤其是氢燃料电池汽车可以实现零污染、零排放,驱动系统几乎无噪音,且氢能取之不尽、用之不竭,因此燃料电池汽车成为汽车企业关注的焦点。燃料电池的燃料可以是氢气、甲醇等。有科技工作者利用稀土金属氧化物作为固体电解质制造出了甲醇—空气燃料电池。这种稀土金属氧化物在高温下能传导O2-。
①该电池的正极反应是___________;负极反应是____________。
②在稀土氧化物的固体电解质中,O2-的移动方向是__________。
③甲醇可以在内燃机中燃烧直接产生动力推动机动车运行,而科技工作者要花费大量的精力研究甲醇燃料汽车,主要原因是___________。
(3)在AgCl的饱和溶液中存在沉淀溶解平衡:AgCl(s) ![]() Ag+(aq)+Cl-(aq),在25℃时,Ksp(AgCl)=1.8×10-10。现将足量氯化银分别放入:
Ag+(aq)+Cl-(aq),在25℃时,Ksp(AgCl)=1.8×10-10。现将足量氯化银分别放入:
①100 mL蒸馏水中;②100 mL 0.2 mol/L AgNO3溶液中;③100 mL 0.1 mol/L氯化铝溶液中;④100 mL 0.1 mol/L盐酸中,充分搅拌后,相同温度下c(Ag+)由大到小的顺序是_____(填写序号);其中②中氯离子的浓度为______mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃,下列有关电解质溶液的说法正确的是
A.向NaF溶液中滴加硫酸至中性时,c(Na+)=2c(SO![]() )+c(F-)
)+c(F-)
B.稀醋酸中加入冰醋酸,醋酸电离平衡右移,电离度增大
C.向氨水中加入NH4Cl固体,溶液中 ![]() 增大
增大
D.将NaClO溶液从20 ℃升温至30 ℃,溶液中![]() 增大
增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com