
| A. | 加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO32- | |
| B. | 加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42- | |
| C. | 加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ba2+ | |
| D. | 加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,一定有NH4+ |
分析 A.HCO3-也可与盐酸反应生成二氧化碳气体;
B.加入氯化钡溶液有白色沉淀产生,可能为AgCl或硫酸钡;
C.可能为碳酸钙等沉淀;
D.能使湿润红色石蕊试纸变蓝的气体为氨气.
解答 解:A.HCO3-也可与盐酸反应生成二氧化碳气体,不一定为CO32-,故A错误;
B.加入氯化钡溶液有白色沉淀产生,可能为AgCl或硫酸钡,不应含有SO42-,可能含有氯离子,如检验SO42-,可先加入盐酸,如无现象再加入氯化钡检验,故B错误;
C.不一定含有钡离子,可能为碳酸钙等沉淀,故C错误;
D.能使湿润红色石蕊试纸变蓝的气体为氨气,则一定含有NH4+,故D正确.
故选D.
点评 本题考查了常见离子的检验方法,题目难度不大,试题有利于培养学生的逻辑思维能力和发散思维能力,提高学生的应试能力和学习效率,该类试题需要注意的是进行离子检验时,要依据离子的特殊性质和特征反应进行判断.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝粉在氧气中燃烧生成Al2O3,故钠在氧气中燃烧生成Na2O | |
| B. | 铁能从硫酸铜溶液中置换出铜,故钠也能从硫酸铜溶液中置换出铜 | |
| C. | 活泼金属钠保存在煤油中,故活泼金属铝也保存在煤油中 | |
| D. | 钠与氧气、水等反应时钠均作还原剂,故金属单质参与反应时金属单质均作还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 压强/106Pa | 1.01 | 2.02 | 40.4 |
| 平衡时c(A)/mol•L-1 | 0.022 | 0.05 | 0.075 |
| A. | ② | B. | ③④ | C. | ②④ | D. | ①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
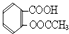 ).实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成乙酰水杨酸,制备的主要反应为:
).实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成乙酰水杨酸,制备的主要反应为:

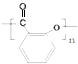 .
.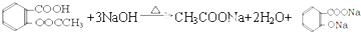 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 100℃时,pH=10的NaOH溶液和pH=2的H2SO4恰好中和,所得溶液的pH=7 | |
| B. | 25℃时,0.2 mol/L Ba(OH)2溶液和0.2 mol/L HCl等体积混合,所得溶液的pH=7 | |
| C. | 25℃时,0.2 mol/L NaOH溶液与0.2 mol/L H2SO4恰好中和,所得溶液的pH<7 | |
| D. | 25℃时,pH=12的氨水和pH=2的H2SO4等体积混合,所得溶液的pH>7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4L氢气和氧气的混合气体,所含分子数为NA | |
| B. | 1molAl3+含有核外电子数为3NA | |
| C. | 常温常压下,1mol氧气所含的原子数为NA | |
| D. | 1molNaCl晶体中含有NA个Na+和NA个Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
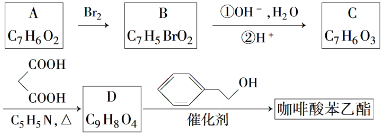
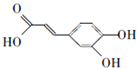 ;
;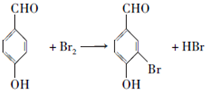 ;
;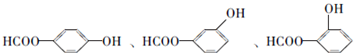 .a.属于酯类 b.能发生银镜反应 c.与FeCl3溶液发生显色反应①
.a.属于酯类 b.能发生银镜反应 c.与FeCl3溶液发生显色反应①查看答案和解析>>
科目:高中化学 来源: 题型:选择题
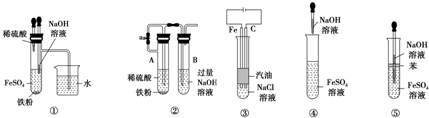
| A. | ①③⑤ | B. | ①②③⑤ | C. | ①②③④⑤ | D. | ③⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com