
| 物质 | 杂质 | 除杂所用试剂和方法 | |
| A | NaCl | CaCl2 | 通足量CO2、过滤 |
| B | KNO3 | K2SO4 | BaCl2溶液、过滤 |
| C | 碘 | H2O | 酒精、分液 |
| D | FeSO4 | CuSO4 | 加入过量铁屑、过滤 |
| A、A | B、B | C、C | D、D |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、将58.5g NaCl固体溶于1 L水中所得溶液 |
| B、将22.4L HCl气体溶于水配成1 L的溶液 |
| C、从1L 10mol/L的浓盐酸中取出的100mL溶液 |
| D、将4g NaOH固体溶于水中配成的100 mL溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、两者的分散质都属于碱 |
| B、两者均为有色不透明的分散系 |
| C、两者分散质的直径都介于10-9~10-7m之间 |
| D、两者都有丁达尔效应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、碳酸氢钙溶液和过量氢氧化钙溶液混合:Ca2++2HCO3-+OH-═CaCO3↓+CO32-+H2O |
| B、CuCl2溶液与Na2S溶液2:1反应,Cu2++S2-═CuS↓ |
| C、用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO4-+6H++5H2O2═2Mn2++5O2↑+8H2O |
| D、向明矾溶液中滴加Ba(OH)2溶液,恰好使SO42-沉淀完全:2Al3++3SO42-+3Ba2++6OH -═2 Al(OH)3↓+3BaSO4↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 纯净物 | 混合物 | 强电解质 | 弱电解质 | 非电解质 | |
| A | 盐酸 | 水煤气 | 硫酸 | 醋酸 | HD |
| B | 胆矾 | 石灰水 | 硫酸钡 | Al(OH)3 | NH3 |
| C | 火碱 | 蔗糖溶液 | 氯化钠 | 氨水 | 三氧化硫 |
| D | 冰醋酸 | 福尔马林 | 苛性钾 | 碘化氢 | 乙醇 |
| A、A | B、B | C、C | D、.D |
查看答案和解析>>
科目:高中化学 来源: 题型:
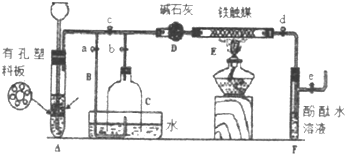
查看答案和解析>>
科目:高中化学 来源: 题型:
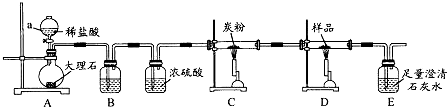
查看答案和解析>>
科目:高中化学 来源: 题型:
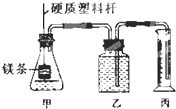 某研究性学习小组为证明在相同条件下,同浓度同体积强弱不同的一元酸与同一种金属反应时,生成氢气的速率不同,同时测定该温度和压强下的气体摩尔体积,设计组装了两套如图所示的简易实验装置.
某研究性学习小组为证明在相同条件下,同浓度同体积强弱不同的一元酸与同一种金属反应时,生成氢气的速率不同,同时测定该温度和压强下的气体摩尔体积,设计组装了两套如图所示的简易实验装置.查看答案和解析>>
科目:高中化学 来源: 题型:
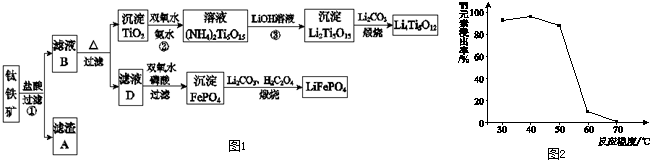
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com