
【题目】某课题组以纳米Fe2O3 作为电极材料制备锂离子电池(另一极为金属锂和石墨的复合材料),通过在室温条件下对锂离子电池进行循环充放电,成功地实现了对磁性的可逆调控(如图)。以下说法正确的是

A. 放电时,正极的电极反应式为Fe2O3+6Li++6e-=2Fe+3Li2O
B. 该电池可以用水溶液做电解质溶液
C. 放电时,Fe作电池的负极,Fe2O3作电池的正极
D. 充电时,电池被磁铁吸引
科目:高中化学 来源: 题型:
【题目】室温下,将尿酸钠(![]() )悬浊液静置,取上层清液,再通入
)悬浊液静置,取上层清液,再通入![]() ,溶液中尿酸的浓度
,溶液中尿酸的浓度![]() 与
与![]() 的关系如图所示。己知:
的关系如图所示。己知:![]() ,
,![]() ,下列说法正确的是
,下列说法正确的是

A. 上层清液中,![]()
B. 当![]() 时,
时,![]()
C. 在![]() 的变化过程中,c(Na+) c(Ur-)的值将逐渐减小
的变化过程中,c(Na+) c(Ur-)的值将逐渐减小
D. 当![]() 时,
时,![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,金属相互化合形成的化合物称为金属互化物,如Cu9Al4、Cu5Zn8等。
(1)某金属互化物具有自范性,原子在三维空间里呈周期性有序排列,该金属互化物属于________(填“晶体”或“非晶体”)。
(2)基态铜原子有________个未成对电子;Cu2+的电子排布式为____________________;在CuSO4溶液中加入过量氨水,充分反应后加入少量乙醇,析出一种深蓝色晶体,该晶体的化学式为____________________,其所含化学键有____________________,乙醇分子中C原子的杂化轨道类型为________。
(3)铜能与类卤素(SCN)2反应生成Cu(SCN)2,1 mol(SCN)2分子中含有σ键的数目为________。(SCN)2对应的酸有硫氰酸(H—S—C≡N)、异硫氰酸(H—N===C===S)两种。理论上前者沸点低于后者,其原因是______________________________________________________________________________________。

(4)ZnS的晶胞结构如图所示,在ZnS晶胞中,S2-的配位数为_______________。
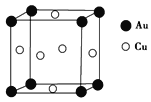
(5)铜与金形成的金属互化物的晶胞结构如图所示,其晶胞边长为a nm,该金属互化物的密度为________ g·cm-3(用含a、NA的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2A+B![]() 3C+4D反应中,表示该反应速率最快的是( )
3C+4D反应中,表示该反应速率最快的是( )
A. υ(A)= 0.5 mol/(L·s) B. υ(B)= 18 mol/(L·min)
C. υ(C)= 0.8 mol/(L·s) D. υ(D)= 1 mol/( L·s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个容积为2L的密闭容器中,加入0.8mol的A2气体和0.6molB2气体,一定条件下发生如下反应:A2(g)+B2(g)![]() 2AB(g) △H<0,反应中各物质的浓度随时间的变化情况如图所示。
2AB(g) △H<0,反应中各物质的浓度随时间的变化情况如图所示。

(1)在上述反应达到平衡后,第4min时,若将容器的体积快速扩大一倍(其他条件不变),请在图中画出4min~5min的AB浓度的变化线__________。
(2)在相同条件下,若开始时向此容器中加入的A2(g)、B2(g)和AB(g)的物质的量分别为0.7mol、0.5mol、0.2mol。则反应向_________反应方向进行(填“正”或“逆”)。判断依据是_______。反应达到平衡后,各物质的体积分数与原平衡相比_______(填序号)。
①A2、B2减小,AB增大 ②A2、B2增大,AB减小 ③均不变 ④无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钠(NaNO2)是一种工业盐,外观与食盐相似。下面是某学习小组设计的NaNO2制取实验和纯度检验实验。该小组收集了相关资料:
①SO2和HNO3溶液反应生成NOx和H2SO4
②3NO2-+2H+=2NO↑+NO3-+H2O
③NO2-+Ag+=AgNO2↓(AgNO2为淡黄色接近白色固体,在水中形成沉淀)
Ⅰ.亚硝酸钠的制取实验

(1)仪器a的名称为________________________,A装置中发生的化学反应方程式为_____________________________________________。
(2)B装置中多孔球泡的作用是_________________________________________________。
(3)若装置B中逸出的NO与NO2气体物质的量之比为2∶1,则装置B中发生反应的化学方程式为_________________________________________________________。
(4)实验过程中需控制C装置中溶液pH>7,否则C中生成的NaNO2的产量会下降,理由是_____________________________________________________。
(5)请根据题干所给信息设计实验证明C装置中有NO2产生:_________________________________。(限选用的试剂:稀硝酸、硝酸银溶液、NaOH溶液)
Ⅱ.亚硝酸钠的纯度检验
已知:NO2-+MnO4-+H+→NO3-+Mn2++H2O
(6)反应结束后C中溶液通过结晶获得NaNO2粗产品mg,溶解后稀释至250mL,分别取25.00mL用cmol/L的酸性KMnO4溶液平行滴定三次,平均每次消耗酸性KMnO4溶液的体积为VmL。则粗产品中NaNO2的质量分数为_____________(用含c、V、m的式子表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示阴阳膜组合电解装置用于循环脱硫,用NaOH溶液在反应池中吸收尾气中的二氧化硫,将得到的Na2SO3溶液进行电解又制得NaOH。其中a、b离子交换膜将电解槽分为三个区域,电极材料为石墨,产品C为H2SO4溶液。下列说法正确的是( )

A. b为只允许阳离子通过的离子交换膜
B. 阴极区中B最初充入稀NaOH溶液,产品E为氧气
C. 反应池采用气、液逆流方式,目的是使反应更充分
D. 阳极的电极反应式为SO32-+2e-+H2O===2H++SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前工业合成氨的原理是:N2(g)+3H2(g)![]() 2NH3(g) △H=-93.0kJ/mol
2NH3(g) △H=-93.0kJ/mol
(1)己知一定条件下:2N2(g)+6H2O(l)![]() 4NH3(g)+3O2(g) △H=+1530.0kJ/mol。则表示氢气燃烧热的热化学方程式为____________________。
4NH3(g)+3O2(g) △H=+1530.0kJ/mol。则表示氢气燃烧热的热化学方程式为____________________。
(2)在恒温恒容装置中进行合成氨反应,各组分浓度-时间图像如下。

① 表示N2浓度变化的曲线是 (填序号)。
② 前25min 内,用H2浓度变化表示的化学反应速率是 。
③ 在25min时,采取下列措施,能使N2的转化率提高的是__________(填序号)。
a. 通入1molN2
b. 通入1molH2
c. 通入1molHe气
d. 通入1molHCl
e. 通入1molN2和3molH2
(3)在恒温恒压装置中进行工业合成氨反应,下列说法错误的是__________(填序号)。
a.气体体积不再变化,则已平衡
b.气体密度不再变化,则已平衡
c.平衡后,压缩容器,会生成更多NH3
d.平衡后,往装置中通入一定量Ar,平衡不移动
(4)电厂烟气脱氮:主反应为:①4NH3(g)+6NO(g)![]() 5N2(g)+6H2O(g) △H<0
5N2(g)+6H2O(g) △H<0
副反应为:②2NH3(g)+8NO(g)![]() 5N2O(g)+3H2O(g) △H>0
5N2O(g)+3H2O(g) △H>0
平衡混合气中N2与N2O含量与温度的关系如图所示。

请回答:在400~600K时,随温度的升高,平衡混合气中N2含量_____________(填“升高”、“降低”或“不变”),导致这种规律的原因是_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:pKa=-lgKa。25℃时,几种弱酸的pKa值如下表所示。下列说法正确的是
弱酸的化学式 | CH3COOH | HCOOH | H2SO3 |
pKa | 4.74 | 3.74 | 1.90 7.20 |
A. 向Na2SO3溶液中加入过量乙酸,反应生成SO2
B. 25℃时,pH=8的甲酸钠溶液中,c( HCOOH)=9.9×10-7mol·L-1
C. 25℃时,某乙酸溶液pH=a,则等浓度的甲酸pH=a-1
D. 相同温度下,等浓度的 HCOONa溶液比Na2SO3溶液的pH大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com