
分析 3Cl2+8NH3═N2+6NH4Cl中,N元素的化合价升高,Cl元素的化合价降低,该反应转移6e-,以此来解答;
解答 解:(1)N元素的化合价升高,Cl元素的化合价降低,则氧化剂为Cl2,还原剂为NH3,
故答案为:Cl2;NH3;
(2)8molNH3完全应时,2molNH3被氧化,则转移电子为6mol,即转移电子数为6NA;
故答案为:6NA;
(3)该反应转移6e-,3molCl2得到电子与2molNH3失去电子转移电子相同,则氧化剂与氧化产物的物质的量比为3:1,则质量比为3×71:1×28=213:28,
故答案为:213:28;
(4)当有68g NH3参加反应时,n(NH3)=$\frac{68g}{17g/mol}$=4mol,其中有$\frac{1}{4}$的氨气被氧化,被氧化的氨气为4mol×$\frac{1}{4}$×17g/mol=17g;Cl元素的化合价降低,被还原,则NH4Cl2为还原产物,4mol氨气反应生成的还原产物为3mol,其质量为160.5g;
故答案为:17;160.5.
点评 本题考查氧化还原反应及计算,把握反应中元素的化合价变化为解答的关键,侧重分析与应用能力的考查,注意氧化剂与还原剂转移电子守恒,题目难度不大.


 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe在一定条件下与水反应生成H2和Fe(OH)3 | |
| B. | Fe3O4溶于盐酸后加入几滴KSCN溶液,溶液不显血红色 | |
| C. | FeCl2溶液蒸干后得到的是Fe(OH)3固体 | |
| D. | 将FeCl3饱和溶液滴入NaOH溶液中可制备Fe(OH)3胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
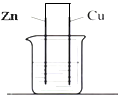
| A. | 该装置中Zn作为正极 | B. | 该装置可以实现电能转化为化学能 | ||
| C. | 电子从锌电极经过溶液到铜电极 | D. | 溶液中的H+移向铜电极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4LNO与11.2LO2混合,混合气体所含分子数为NA | |
| B. | 1molAl3+含有的核外电子数为10NA | |
| C. | 常温常压下,1mol氮气含有的原子总数为2NA | |
| D. | 1L1mol/LFeCl3溶液全部制成胶体,其中含胶粒的数目小于NA |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 W、X、Y、Z 是四种常见的短周期元素,其原子半径随原子序数变化如图所示.已知W的一种核素的质量数为18,中子数为10,X和Ne的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的吸引电子的能力在同周期主族元素中最大.
W、X、Y、Z 是四种常见的短周期元素,其原子半径随原子序数变化如图所示.已知W的一种核素的质量数为18,中子数为10,X和Ne的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的吸引电子的能力在同周期主族元素中最大.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
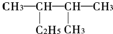 ,下列对该烷烃的系统命名中正确的是( )
,下列对该烷烃的系统命名中正确的是( )| A. | 3-甲基-2-乙基丁烷 | B. | 2-甲基-3-乙基丁烷 | ||
| C. | 2,3-二甲基戊烷 | D. | 3,4-二甲戊烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只由非金属元素组成的化合物一定是共价化合物 | |
| B. | 只含离子键的纯净物一定是离子化合物 | |
| C. | Cl2和H2O两种分子中,每个原子的最外层都具有8电子稳定结构 | |
| D. | 固体二氧化硫是分子晶体,其溶于水生成亚硫酸的过程只需克服分子间作用力 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com