
分析 向 FeBr2溶液中通入氯气,由于Fe2+的还原性强于Br-,故氯气先与Fe2+反应,待Fe2+反应完全后,氯气再与Br-反应.
(1)当x≤0.5n mol时,此时氯气只与Fe2+反应;
(2)当x≥1.5n mol时,氯气过量,能将Fe2+和Br-均反应完全,且由于在FeBr2溶液中,Fe2+和Br-的物质的量之比为1:2,故书写离子方程式时,Fe2+和Br-的物质的量之比为1:2;
(3)当x=n mol时,氯气先与nmolFe2+反应,消耗0.5nmol氯气,剩余的0.5nmol氯气又能反应掉nmolBr-,即书写离子方程式时,参与反应的Fe2+和Br-的物质的量之比为1:1,据此分析.
解答 解:向 FeBr2溶液中通入氯气,由于Fe2+的还原性强于Br-,故氯气先与Fe2+反应,而nmolFe2+完全反应时能消耗0.5nmol氯气,待Fe2+反应完全后,氯气再与Br-反应.
(1)当x≤0.5n mol时,氯气先与Fe2+反应,而nmolFe2+完全反应时能消耗0.5nmol氯气,故当x≤0.5n mol时氯气只与Fe2+反应,故离子方程式为:2Fe2++Cl2═2Fe3++2Cl-,故答案为:2Fe2++Cl2═2Fe3++2Cl-;
(2)n mol FeBr2完全被氧化消耗1.5nmol氯气,故当x≥1.5n mol时,氯气过量,能将Fe2+和Br-均反应完全,且由于在FeBr2溶液中,Fe2+和Br-的物质的量之比为1:2,故书写离子方程式时,Fe2+和Br-的物质的量之比为1:2,故离子方程式为:2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl-,故答案为:2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl-.
(3)氯气先与Fe2+反应,而nmolFe2+完全反应时能消耗0.5nmol氯气,剩余的0.5nmol氯气又能反应掉nmolBr-,故当x=n mol时,参与反应的Fe2+和Br-的物质的量之比为1:1,故离子方程式为:2Fe2++2Br-+2Cl2═2Fe3++Br2+4Cl-.故答案为:2Fe2++2Br-+2Cl2═2Fe3++Br2+4Cl-.
点评 本题考查了与量有关的离子方程式的书写,难度不大,应注意的是通入氯气的反应的先后顺序以及氯气的量对离子方程式的影响.


科目:高中化学 来源: 题型:解答题
| 品名 | 浓缩菠萝汁 |
| 配料 | 水、浓缩菠萝汁、蔗糖、柠檬酸、甜蜜素、维生素C、菠萝香精、柠檬黄、日落黄、山梨酸钾等. |
| 性质 | 亚硝酸钠 | 氯化钠 |
| 1.酸性条件下的稳定性 | 微热时分解为NO和NO2 | 微热时不分解 |
| 2.熔点 | 271℃ | 801℃ |
| 3.室温时的溶解度 | 约80g | 约35g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

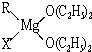 中的配位键
中的配位键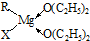
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 9:2 | B. | 10:1 | C. | 11:1 | D. | 12:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 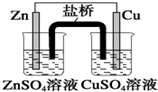 装置中,盐桥中的K+移向ZnSO4溶液 | |
| B. | 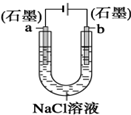 装置工作一段时间后,a极附近溶液的pH增大 | |
| C. | 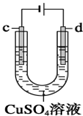 用装置精炼铜时,c极为精铜,电解过程中CuSO4溶液没有变化 | |
| D. | 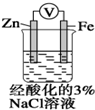 装置中电子由Zn流向Fe,装置中有Fe2+生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1000d×A%=C×M | B. | C=$\frac{1000dW}{(W+1000)M}$ | C. | S=$\frac{100W}{1000V}$ | D. | A%=[$\frac{W}{W+1000V}$]% |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com