
| 品名 | 浓缩菠萝汁 |
| 配料 | 水、浓缩菠萝汁、蔗糖、柠檬酸、甜蜜素、维生素C、菠萝香精、柠檬黄、日落黄、山梨酸钾等. |
| 性质 | 亚硝酸钠 | 氯化钠 |
| 1.酸性条件下的稳定性 | 微热时分解为NO和NO2 | 微热时不分解 |
| 2.熔点 | 271℃ | 801℃ |
| 3.室温时的溶解度 | 约80g | 约35g |
分析 (1)食品添加剂的品种很多,作用各不相同,主要包括着色剂、调味剂、防腐剂、营养强化剂.
各食品添加剂的作用为:
着色剂-改善食品的外观;
调味剂-增添食品的味道;
防腐剂-防止食品腐烂、变质;
营养强化剂-增强食品的营养价值;
根据各食品添加剂的作用分析;
(2)鉴别NaNO2和NaCl,利用表格中二者性质的不同点进行鉴别.
解答 解:(1)食品添加剂的品种很多,作用各不相同,主要包括着色剂、调味剂、防腐剂、营养强化剂.
着色剂包括胡萝卜素、胭脂红、柠檬黄、苋菜红、日落黄等,所以该题中属于着色剂的为柠檬黄、日落黄.
调味剂包括食盐、醋、味精、蔗糖、柠檬酸、甜蜜素、香精等,所以该题中属于调味剂的有蔗糖、柠檬酸、甜蜜素、菠萝香精.
防腐剂包括食盐、醋、苯甲酸钠、山梨酸钾、亚硝酸盐等,所以该题中属于防腐剂的为山梨酸钾;
浓缩菠萝汁富含维生素C;
故答案为:柠檬黄、日落黄;蔗糖、柠檬酸、甜蜜素、菠萝香精;山梨酸钾;浓缩菠萝汁、维生素C;
(2)由图可知,鉴别NaNO2和NaCl的方法:将两种固体分别溶于水制成溶液,再分别加入稀硫酸微热,有气泡生成的是亚硝酸钠,否则为氯化钠,
故答案为:溶于水制成溶液,加入稀硫酸微热,有棕色气体生成者,原物质为NaNO2,否则为NaCl;或用酒精灯加热,熔化者为NaNO2,不熔者为NaCl;或取两支试管,各加入5 mL水,分别溶解这两种物质,至不再溶解时,溶解量大的为亚硝酸钠,溶解量小的为氯化钠.
点评 本题考查物质的检验及鉴别和常用的食品添加剂,明确物质的性质是解答本题的关键,注意物质性质的差异即可解答,题目难度不大.


 金钥匙试卷系列答案
金钥匙试卷系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| A | B | C | D | E |
| ①能使溴水褪色 ②比例模型为  ③能与水在一定条件下反应生成物质C | ①由C、H两 种元素组成 ②球棍模型为 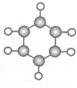 | ①由C、H、O三种元素组成 ②能与Na反应,但不能与NaOH溶液反应 ③能与E反应生成相对分子质量为100的酯 | ①相对分子质量 比物质C小2②能由物质C氧化而成 | ①由C、H、O三种元素组成 ②球棍模型为  |
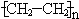 .
.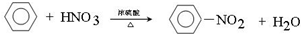 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2的摩尔质量是2 g | B. | 1 mol H2O的质量是18 g/mol | ||
| C. | 氧气的摩尔质量是32 g/mol | D. | 2 g H2含1 mol H |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O2在反应①中作氧化剂,在反应②中作还原剂 | |
| B. | 在H2O2分解过程中,溶液的pH逐渐减小 | |
| C. | 在H2O2分解过程中,Fe2+起到催化剂的作用 | |
| D. | H2O2生产过程要严格避免混入Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
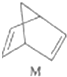 $?_{暗处}^{光照}$
$?_{暗处}^{光照}$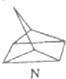 △H═88.6kJ•mol-1
△H═88.6kJ•mol-1查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com