
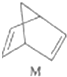
 $?_{暗处}^{光照}$
$?_{暗处}^{光照}$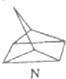 △H═88.6kJ•mol-1
△H═88.6kJ•mol-1分析 (1)M转化为N是吸热反应,所以N的能量高,不稳定;
(2)甲醇燃烧生成CO2(g)和H2(g)属于不完全燃烧,放出的热量少,故a<238.6;
(3)有1mol Cl2参与反应时释放出145kJ热量,2mol氯气反应放热290kJ,注物质聚集状态和对应反应焓变写出热化学方程式;
(4)所给反应中转移12个电子,故每转移1mol电子放出的热量为1 176kJ÷12=98kJ;
(5)已知:①Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g)△H=+489.0kJ•mol-1
②CO(g)+1/2O2(g)=CO2(g)△H=-283.0kJ•mol-1111]
③C(石墨)+O2(g)=CO2(g)△H=-393.5kJ•mol-1
则关键盖斯定律可知(③×3-①-②×3)×2即得.
解答 解:(1)有机物M经过太阳光光照可转化成N,:△H=+88.6kJ•mol-1,过程是吸热反应,N暗处转化为M,是放热反应,能量越低越稳定,说明M稳定;
故答案为:M;
(2)燃烧热是1mol物质完全燃烧生成稳定氧化物放出的热量,甲醇燃烧生成CO2(g)和H2(g)属于不完全燃烧,放出的热量小于燃烧热;
故答案为:<;
(3)有1mol Cl2参与反应时释放出145kJ热量,2mol氯气反应放热290kJ,反应的热化学方程式为:2Cl2(g)+2H2O(g)+C(s)═4HCl(g)+CO2(g)△H=-290kJ•mol-1 ;
故答案为:2Cl2(g)+2H2O(g)+C(s)═4HCl(g)+CO2(g)△H=-290kJ•mol-1 ;
(4)4Al(s)+3TiO2(s)+3C(s)═2Al2O3(s)+3TiC(s)△H=-1176kJ•mol-1,转移12mol电子放热1176KJ,则反应过程中,每转移1mol电子放热98kJ,
故答案为:98kJ;
(5)已知:①Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g)△H=+489.0kJ•mol-1
②CO(g)+1/2O2(g)=CO2(g)△H=-283.0kJ•mol-1111]
③C(石墨)+O2(g)=CO2(g)△H=-393.5kJ•mol-1
则关键盖斯定律可知(③×3-①-②×3)×2即得到4Fe(s)+3O2(g)=2Fe2O3(s)的△H=-1641.0kJ•mol-1,故答案为:-1641.0kJ•mol-1.
点评 本题考查了化学反应能量变化,燃烧热概念分析判断,氧化还原反应电子转移的计算应用,掌握基础是解题关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 常温下,c(H+)/c(OH一)=1×10-12的溶液:K+、AlO2-、SiO32-、Na+ | |
| B. | 加入KSCN显红色的溶液:K+、NH4+、Cl-、I- | |
| C. | 加入石蕊显蓝色的溶液:Cu2+、Al3+、NO3-、SO42- | |
| D. | 加入Al能放出大量H2的溶液中:NH4+、Fe2+、NO3-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 品名 | 浓缩菠萝汁 |
| 配料 | 水、浓缩菠萝汁、蔗糖、柠檬酸、甜蜜素、维生素C、菠萝香精、柠檬黄、日落黄、山梨酸钾等. |
| 性质 | 亚硝酸钠 | 氯化钠 |
| 1.酸性条件下的稳定性 | 微热时分解为NO和NO2 | 微热时不分解 |
| 2.熔点 | 271℃ | 801℃ |
| 3.室温时的溶解度 | 约80g | 约35g |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 反应结束时溶液的pH=7 | |
| B. | 反应后溶液中存在的粒子只有Na+和Cl- | |
| C. | 该反应的实质是H+和OH-结合生成水 | |
| D. | 反应前后所有元素的化合价均无变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

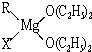 中的配位键
中的配位键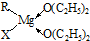
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com