
���� ��1����������������ʵ��������ݷ���ʽ������������ͭ�����ʵ������ٸ���c=$\frac{n}{V}$����ϡ�ͺ�����ͭ�����ʵ���Ũ�ȣ�
��2��������Ӧ��SO2+2NaOH=Na2SO3+H2O����������NaOH���ʵ������ٸ���V=$\frac{n}{c}$������Ҫ����������Һ�����
��� �⣺��1�����ɶ����������ʵ���Ϊ$\frac{3.36L}{22.4L/mol}$=0.15mol��
��Cu+2H2SO4��Ũ��$\frac{\underline{\;\;��\;\;}}{\;}$CuSO4+SO2��+2H2O����֪n��CuSO4��=n��SO2��=0.15mol��
��ϡ�ͺ�c��CuSO4��=$\frac{0.15mol}{0.5L}$=0.3mol/L��
����Һ������ͭ�����ʵ���Ũ����0.3mol/L��
��2��������Ӧ��SO2+2NaOH=Na2SO3+H2O����֪����NaOH���ʵ���Ϊ0.15mol��2=0.3mol����Ҫ����������Һ���Ϊ$\frac{0.3mol}{0.2mol/L}$=1.5L��
������Ũ��Ϊ0.2mol/L��NaOH��Һ�������1.5L��
���� ���⿼�黯ѧ����ʽ���㡢���ʵ���Ũ���йؼ��㣬��Ŀ�Ƚϻ�����ע������ʵ���Ũ�ȶ���ʽ���������Ӧ�ã�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
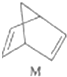 $?_{����}^{����}$
$?_{����}^{����}$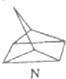 ��H�T88.6kJ•mol-1
��H�T88.6kJ•mol-1�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��ʯ���еõ����ɷ֣���������ķ���������Ϊ�������� | |
| B�� | ��ȡ��ˮ�е��壬���ü����Ҵ���ȡ�ķ��� | |
| C�� | ֻ������ɳ�Ĵ��Σ���ͨ���ܽ⡢���ˡ��ᾧ�ķ����ᴿ | |
| D�� | ����FeCl2��Һ�������Լ�ƿ�м���һ��������м |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | $\frac{a+b}{4}$ | B�� | 4��3a+b�� | C�� | 4��a+b�� | D�� | $\frac{3a+b}{4}$ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��400mol•L-1 | B�� | 20��mol•L-1 | C�� | 2.5��mol•L-1 | D�� | 1.25��mol•L-1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Fe��һ����������ˮ��Ӧ����H2��Fe��OH��3 | |
| B�� | Fe3O4�����������뼸��KSCN��Һ����Һ����Ѫ��ɫ | |
| C�� | FeCl2��Һ���ɺ�õ�����Fe��OH��3���� | |
| D�� | ��FeCl3������Һ����NaOH��Һ�п��Ʊ�Fe��OH��3���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
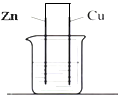
| A�� | ��װ����Zn��Ϊ���� | B�� | ��װ�ÿ���ʵ�ֵ���ת��Ϊ��ѧ�� | ||
| C�� | ���Ӵ�п�缫������Һ��ͭ�缫 | D�� | ��Һ�е�H+����ͭ�缫 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ֻ�ɷǽ���Ԫ����ɵĻ�����һ���ǹ��ۻ����� | |
| B�� | ֻ�����Ӽ��Ĵ�����һ�������ӻ����� | |
| C�� | Cl2��H2O���ַ����У�ÿ��ԭ�ӵ�����㶼����8�����ȶ��ṹ | |
| D�� | ������������Ƿ��Ӿ��壬������ˮ����������Ĺ���ֻ��˷����Ӽ������� |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com