
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 分子晶体中一定含有共价键,不含有离子键 | |
| B. | 仅含共价键的物质不一定是共价化合物 | |
| C. | 原子晶体中只存在非极性共价键 | |
| D. | 不同原子形成的纯净物一定是化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
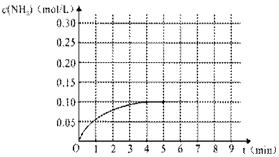 在一容积为2L的密闭容器内加入0.2mol的N2和0.6mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g)?2NH3(g )△H<0,反应中NH3的物质的量浓度的变化的情况如图:
在一容积为2L的密闭容器内加入0.2mol的N2和0.6mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g)?2NH3(g )△H<0,反应中NH3的物质的量浓度的变化的情况如图:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 编号 | 纯净物 | 混合物 | 碱性氧化物 | 非电解质 |
| A | 液氯 | 漂白粉 | Al2O3 | CO |
| B | 纯碱 | 浓硫酸 | CaO | 乙醇 |
| C | 碱石灰 | 王水 | K2O | Cl2 |
| D | 胆矾 | 水玻璃 | Na2O2 | SO2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 被提纯的物质 | 杂质 | 除杂试剂 | 除杂方法 |
| A | CO(g) | CO2(g) | NaOH 溶液、浓 H2SO4 | 洗气 |
| B | NH4Cl (aq) | Fe3+(aq) | NaOH溶液 | 过滤 |
| C | Fe粉 | Al粉 | NaOH溶液 | 过滤 |
| D | Na2CO3(s) | NaHCO3(s) | - | 灼烧 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 呈碱性 | B. | 呈酸性 | C. | 呈中性 | D. | c(H+)=c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 12g的金刚石晶体中含有碳碳键的数目为4NA | |
| B. | 46g四氧化二氮含有的原子总数一定为3NA | |
| C. | 500mLl.0mol/L的乙酸溶液中含有的H+数为0.5NA | |
| D. | 1 molFeCl3制成胶体,所得胶体的粒子数为NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com