
| A. | 一定条件下6.4g SO2与足量氧气反应生成SO3,转移电子数为0.2 NA | |
| B. | 1 mol AlCl3在熔融状态时离子总数为0.4NA | |
| C. | 标况下,11.2 L氯气完全溶于1 L水中,所得溶液中Cl-和ClO-两种粒子数之和为NA | |
| D. | 6.4 g由S2、S4、S8组成的混合物含硫原子数为0.2 NA |
分析 A、二氧化硫与氧气生成三氧化硫的反应为可逆反应,反应物不可能完全转化成生成物;
B、氯化铝为共价化合物;
C、氯气与水反应是可逆反应,不可能反应完全;
D、S2、S4、S8都是与S原子构成的,6.4g混合物中含有6.4gS原子,含有0.2mol硫原子;
解答 解:A、6.4g二氧化硫的物质的量为0.1mol,由于二氧化硫转化成 三氧化硫的反应为可逆反应,则反应生成的三氧化硫小于0.1mol,转移的电子小于0.2mol,故A错误;
B、氯化铝为共价化合物,在熔融状态下以分子形式存在,不能电离为离子,故B错误;
C、氯气与水反应是可逆反应,不可能反应完全,所得溶液中Cl-和ClO-两种粒子数之和小于NA,故C错误;
D、6.4gS2、S4、S8的混合物中含有6.4gS原子,含有0.2mol硫原子,所含S原子数为0.2NA,故D正确;
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2017届吉林省长春市高三上学期期中考试化学试卷(解析版) 题型:计算题
综合题:
氢气是清洁的能源,也是重要的化工原料,根据以下三种制氢方法。完成下列问题:
(1)方法一:H2S热分解法,反应式为:2H2S(g) 2H2(g)+S2(g)△H
2H2(g)+S2(g)△H
在恒容密闭容器中,测定H2S分解的转化率(H2S的起始浓度均为cmol/L),测定结果见下图,图中曲线a表示H2S的平衡转化率与温度关系,曲线b表示不同温度下反应经过相同时间未达到化学平衡时H2S的转化率。
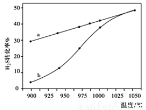
①△H0,(“>”、“<”或“=”)。
②若985℃时,反应经tmin达到平衡,此时H2S的转化率为40%,则tmin内反应速率v(H2)=
(用含c、t的代数式表示)。
③请说明随温度的升高,曲线b向曲线a接近的原因:。
(2)方法二:以CaO为吸收体,将生物材质(以C计)与水蒸气反应制取H2。相关主要反应如下:
I:C(s)+H2O(g)═CO(g)+H2(g)△H=+131.0kJ/mol
Ⅱ:CO(g)+H2O(g)═CO2(g)+H2(g)△H=-43kJ/mol
Ⅲ:CaO(s)+CO2(g)═CaCO3(s)△H=-178.3kJ/mol
①计算反应C(s)+2H2O(g)+CaO(s) CaCO3(s)+2H2(g)的△H=kJ/mol;
CaCO3(s)+2H2(g)的△H=kJ/mol;
若K1、K2、K3分别为反应I、Ⅱ、Ⅲ的平衡常数,该平衡常数K=(用K1、K2、K3表示)。
②对于可逆反应C(s)+2H2O(g)+CaO(s) CaCO3(s)+2H2(g),采取以下措施可以提高H2产率的是。(填字母)
CaCO3(s)+2H2(g),采取以下措施可以提高H2产率的是。(填字母)
A.降低体系的温度
B.压缩容器的体积
C.增加CaO的量
D.选用适当的催化剂
(3)方法三:利用甲醇可以与水蒸气反 应制取H2,反应方程式如下:
应制取H2,反应方程式如下:
CH3OH(g)+H2O(g) CO2(g)+3H2(g)△H=+49.4kJ/mol
CO2(g)+3H2(g)△H=+49.4kJ/mol
一定温度下,向容积为2L的密闭恒容容器中充入1molCH3OH(g)和3molH2O(g),达到平衡状态时,吸收热量19.76kJ。则
①达平衡时混合气体的压强是反应前的倍。
②此温度下的该反应的平衡常数是(保留两位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 信息:在20℃、1个大气压下,水可以结成冰,称为“热冰”(如图):
信息:在20℃、1个大气压下,水可以结成冰,称为“热冰”(如图):查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由反应可知化学计量数存在如下关系:2b=5c+d | |
| B. | 若化学计量数a=8,b=3,则电子数转移为20e- | |
| C. | 若氯酸分解所得的lmol混合气体质量为47.6g,则反应方程式可表示为:26HClO3→15O2↑+8C12↑+10HClO4+8H2O | |
| D. | 变蓝的淀粉碘化钾试纸褪色是因为漂白 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol/LNaHCO3溶液中:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) | |
| B. | 等浓度等体积的Na2CO3溶液与NaClO溶液混合后:2c(Na+)=3c(ClO-)+3c(HClO)+3c(HCO3-)+3c(CO32-)+3c(H2CO3) | |
| C. | 室温下,KOH与苯酚混合pH=7的溶液中:c(K+)>c(C6H5O-)>c(H+)=c(OH-) | |
| D. | 某温度下,水的离子积常数Kw=10-13,在此温度下,将pH=12的NaOH溶液Va L与pH=2的硫酸Vb L混合,所得溶液呈中性,则Va:Vb=10:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 因为氯气具有酸性,所以可与烧碱或石灰乳反应制备含氯消毒剂 | |
| B. | 除去乙酸乙酯中少量的乙酸:用饱和碳酸钠溶液洗涤、分液 | |
| C. | 过氧化钠中含有离子键和非极性共价键,阴离子与阳离子的物质的量之比为1:2 | |
| D. | 植物油的不饱和程度高于动物油,植物油更易氧化变质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 8gCH 4中含有的共价键总数为NA | |
| B. | 3.2g的Cu与足量的浓HNO3反应生成的气体分子数为NA | |
| C. | 含有NA个中子的D2O的质量为2.0g | |
| D. | PH=2的硫酸氢钠溶液中的硫酸根离子数为0.01NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验目的 | 实验方案 |
| A | 检验淀粉是否水解生成葡萄糖 | 向淀粉溶液中加入稀H2SO4,加热几分钟,冷却后水解液用NaOH溶液中和,然后再加入新制Cu(OH)2浊液,加热,观察是否有红色沉淀生成 |
| B | 检验Fe(NO3)2晶体是否已氧化变质 | 将Fe(NO3)2样品溶于稀硫酸后,滴加KSCN溶液,观察溶液是否变红 |
| C | 验证Br2的氧化性强于I2 | 将少量溴水加入KI溶液中,再加入CCl4,振荡,静置,可观察到下层液体呈紫色 |
| D | 验证Fe(OH)3的溶解度小于Mg(OH)2 | 将FeCl3溶液加入Mg(OH)2悬浊液中,振荡,可观察到沉淀由白色变为红褐色 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com