
【题目】用下列实验装置进行相应的实验,不能达到实验目的是( )
A | B | C | D | |
装置 |
|
|
|
|
实验 | 结合秒表定量比较锌与不同浓度的稀硫酸反应的快慢 | 证明温度对化学平衡的影响 | 验证铁钉发生吸氧腐蚀 | 可证明非金属性 C>Si |
A. A B. B C. C D. D
 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案科目:高中化学 来源: 题型:
【题目】(1)中国古代四大发明之一黑火药,它的爆炸反应为2KNO3+3C+S =A + N2↑ +3CO2↑(已配平)
①除S外,上述反应中所涉及到的非金属元素的电负性从大到小顺序依次为_____________,K2O,CO2,SO2,SiO2四种晶体的熔点由高到低的顺序______________________
②生成物A的电子式为_____________。推算HCN分子中![]() 键与
键与![]() 键数目之比为_______________。
键数目之比为_______________。
(2)原子序数小于36的元素Q和T,在周期表中既处于同一周期又位于同一族,且原子序数T比Q多 2。T在元素周期表中的位置为__________________,1molQ2+的未成对电子数是__________个。
(3)在![]() 的水溶液中,一定条件下存在组成为
的水溶液中,一定条件下存在组成为![]() (n和x均为正整数)的配离子,将其通过氢离子交换树脂(R-H),可发生离子交换反应:
(n和x均为正整数)的配离子,将其通过氢离子交换树脂(R-H),可发生离子交换反应:
[CrCln(H2O)6-n]x+ + xR-H = Rx[CrCln (H2O)6-n] + xH+
交换出来的H+经中和滴定,即可求出x和n,从而确定配离子的组成。
将含0.0015 mol ![]() 的溶液,与R-H完全交换后,中和交换过程中生成的H+需浓度为0.1200 mol·L-1 的NaOH溶液25.00 ml,则该配离子的化学式为_________________________。
的溶液,与R-H完全交换后,中和交换过程中生成的H+需浓度为0.1200 mol·L-1 的NaOH溶液25.00 ml,则该配离子的化学式为_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组同学利用以下装置制取并探究氨气的性质:

(1)装置A中发生反应的化学方程式为 ___________。
(2)装置B中的干燥剂是_______(填名称)。
(3)装置C中的现象是 _______。
(4)实验进行一段时间后,挤压装置D中的胶头满管,滴入1-2滴浓硫酸,可观察到的现象是_______。
(5)为防止过量氨气外逸,需要在上述装置的末端增加—个尾气吸收装置,应选用的装置是_______(填 “E"成“F"),尾气吸收过程中发生反应的化学方程式为 ________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2 是一种高效安全的杀菌消毒剂。用氯化钠电解法生成ClO2的工艺原理示意图如下图, 发生器内电解生成ClO2。下列说法正确的是
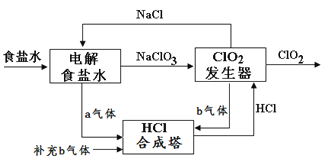
A. a气体是氯气,b气体是氢气
B. 氯化钠电解槽内每生成2 mol a气体,转移2mol e-
C. ClO2发生器中阴极的电极反应式为:2ClO3- + 12H+ + 10e-![]() Cl2↑ + 6H2O
Cl2↑ + 6H2O
D. 为使a、b气体恰好完全反应,理论上每生产1molClO2需要补充56L(标准状况)b气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分某化学兴趣小组在实脸室模拟侯德榜制碱法制备纯碱。主要步骤如下:
第一步:配制饱和NaCl溶液,倒入烧杯中加热;
第一步:控制温度在30-35 ℃。边搅拌边分批加入研细的NH4HCO3固体,加料完毕后,继续保温30分钟;
第三步:静置、过滤得NaHCO3晶体.用少量蒸馏水洗涤除去杂质,然后抽干;
第四步:将第二步所得固体转入蒸发皿中,灼烧2小时,制得纯碱固体,
已知:温度高于35℃时,NH4HCO3会分解。有关盐的溶解度(g/100g水)如下表:
盐 | 0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | 60℃ | 100℃ |
NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 | 39.8 |
NH4HCO3 | 11.9 | 15.8 | 21.0 | 27.0 | —— | —— | —— | —— |
NaHCO3 | 6.9 | 8.1 | 9.6 | 11.l | 12.7 | 14.5 | 16.4 | —— |
NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 | 55.3 | 77.3 |
回答下列问题:
(1)反应温度控制在30-35℃范围内,应采取的加热方法为 ,反应温度不能高于35℃的理由是 .
(2)第三步静置后析出NaHCO3晶体的原因是 ;用蒸馏水洗涤NaHCO3晶体的目的是除去杂质粒子 (用离子符号表示)。
(3)若向过滤所得母液中加入 (填写试剂名称),并作进一步处理,使NaCl溶液循环使用,同时可回收NH4Cl。
(4)纯碱产品不纯,含有NaHCO3、NaCl等杂质。测定纯碱中NaHCO3含量的方法是:准确称取纯碱样品Wg,放入锥形瓶中加蒸馏水溶解,加l-2滴酚酞指示剂,用物质的量浓度为cmol/L的盐酸滴定至溶液由红色到无色(指示CO32-+H+=HCO3-反应的终点), 所用盐酸体积为V1mL,再加1-2滴甲基橙指示剂,继续用盐酸滴定至溶液由黄变橙,所用盐酸总体积为V2mL。
① 实验室配制一定体积cmol/L盐酸需用的仪器除了容量瓶、烧杯、量筒外还需 ;在容量瓶的使用方法中,下列操作正确的是 (填写标号)
a.使用容量瓶前检验它是否漏水
b.容量瓶用蒸馏水洗净后,再用待配溶液润洗
c.配制溶液时,如果试样是固体,把称好的试样用纸条小心倒入容量瓶中.然后加蒸馏水定容
d.用容量瓶把溶液配制完成以后.直接贴上标签,放置备用
e.定容后盖好瓶塞,用食指顶住瓶塞,用另一只手指托住瓶底,把容量瓶倒转和摇动几次
② 写出纯碱样品中NaHCO3质量分数的计算式:NaHCO3(%)= 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解硫酸钠溶液联合生产硫酸和烧碱溶液的装置 如右下图所示,其中阴极和阳极均为惰性电极。测得同温同压下,气体甲与气体乙的体积比约为1︰2,以下说法不正确的是

A. a极与电源的正极相连
B. 产物丙为硫酸溶液
C. 离子交换膜d为阳离子交换膜(允许阳离子通过)
D. a电极反应式为2H2O+2e-=2OH-+ H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某元素X的气态氢化物在高温下分解为固态的X单质和H2,分解反应前后气体的质量之比是17:1。下列有关叙述中错误的是
A. X的阴离子的电子排布式是1s22s22p63s23p6
B. X的最高价氧化物对应的水化物的酸性比砷酸强
C. X的最高价氧化物中,X的质量分数为50%
D. X的气态氢化物的水溶液呈酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于CaF2的表述正确的是
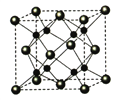
A. Ca2+与F-间仅存在静电吸引作用
B. F-的离子半径小于Cl-,则CaF2的熔点高于CaCl2
C. 阴阳离子比为2:1的物质,均与CaF2晶体构型相同
D. CaF2中的化学键为离子键,因此CaF2在晶体状态下能导电
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A的分子式为C4H4O3 ,根据图示填空。

(1)化合物A中含有的官能团是________(填名称)。
(2)1 mol A与2 mol H2反应生成1 mol E,写出该反应的方程式_______________________ ,该反应的反应类型为_________,
(3)与A具有相同官能团的A的同分异构体的结构简式是_______。
(4)B在酸性条件下与Br2反应得到D,D的结构简式是______________。
(5)F的结构简式是________;
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com