
【题目】某元素X的气态氢化物在高温下分解为固态的X单质和H2,分解反应前后气体的质量之比是17:1。下列有关叙述中错误的是
A. X的阴离子的电子排布式是1s22s22p63s23p6
B. X的最高价氧化物对应的水化物的酸性比砷酸强
C. X的最高价氧化物中,X的质量分数为50%
D. X的气态氢化物的水溶液呈酸性
 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案科目:高中化学 来源: 题型:
【题目】下列关于晶体的结构和性质的叙述正确的是( )
A. 分子晶体中一定含有共价键
B. 原子晶体中共价键越强,熔点越高
C. 离子晶体中含有离子键,不含有共价键
D. 金属阳离子只能存在于离子晶体中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中T所处的周期序数与族序数相等。下列判断不正确的是
![]()
A. 最简单气态氢化物的热稳定性:R>Q
B. 最高价氧化物对应水化物的酸性:Q<W
C. 原子半径:T>Q>R
D. 含T的盐溶液一定显酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列实验装置进行相应的实验,不能达到实验目的是( )
A | B | C | D | |
装置 |
|
|
|
|
实验 | 结合秒表定量比较锌与不同浓度的稀硫酸反应的快慢 | 证明温度对化学平衡的影响 | 验证铁钉发生吸氧腐蚀 | 可证明非金属性 C>Si |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一块铝箔用砂纸打磨表面后,在酒精灯上加热至熔化,下列说法正确的是:
A. 熔化的是铝 B. 熔化的是Al2O3 C. 熔化物迅速燃烧 D. 熔化物迅速滴落下来
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1994年度诺贝尔化学奖授予为研究臭氧作出特殊贡献的化学家。O3能吸收有害紫外线,保护人类赖以生存的空间。O3分子的结构如图,呈V型,键角116.5℃。三个原子以一个O原子为中心,与另外两个O原子分别构成一个非极性共价键;中间O原子提供2个电子,旁边两个O原子各提供1个电子,构成一个特殊的化学键——三个O原子均等地享有这4个电子。请回答:
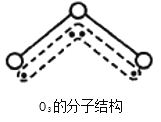
(1)选出下列分子与O3分子的结构最相似的的是___________。
A. H2O B.CO2 C.SO2 D.BeCl2
(2)分子中某原子有1对没有跟其他原子共用的价电子叫孤对电子,那么O3分子有___________对孤对电子。
(3)O3分子是_____________分子(填极性或非极性)。
(4)O3 能使淀粉碘化钾试纸变蓝2KI+O3+H2O===2KOH+I2+O2则氧化产物和还原产物的物质的量之比为____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列比较不正确的是( )
A. 非金属性:C>NB. 酸性:HClO4>H2CO3
C. 碱性:NaOH>Mg(OH)2D. 热稳定性H2O>H2S
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钒及其化合物广泛用于催化剂和新型电池等。工业上以富钒炉渣(主要成分V2O5、Fe2O3和SiO2等)为原料提取五氧化二钒的工艺流程如下图所示:

(1)该工艺流程中可以循环利用的物质有______________。
(2)焙烧炉中发生的主要反应化学方程式为___________________,焙烧炉中可用Na2CO3代替NaCl与富钒炉渣焙烧制得偏钒酸钠。用Na2CO3代替NaCl的优点是____________________。

(3)234g固体偏钒酸铵在煅烧过程中,固体的质量减少值(△W)随温度变化的曲线如图所示。其分解过程中_________。(NH4VO3相对分子质量为117)
a.先分解失去NH3,再分解失去H2O
b.先分解失去H2O,再分解失去NH3
c.同时失去H2O和NH3
d.同时失去H2、N2和H2O
(4)为测定该产品的纯度,兴趣小组同学准确称取产品V2O5 2.0 g,加入足量稀硫酸使其完全生成(VO2)2SO4并配成250 mL溶液。取25.00 mL溶液用0.1000 mol· L-1的H2C2O4。标准溶液滴定,滴定到终点时消耗标准液10.00 mL。反应的离子方程式为:2VO2++ H2C2O4+2H+==2VO2++2CO2↑+2H2O。该产品的纯度为__________。
(5)V2O5具有强氧化性,能与盐酸反应生成氯气和VO+。该反应的离子反应方程式为____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com