


科目:高中化学 来源: 题型:
| 族周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | A | |||||||
| 2 | D | E | G | I | ||||
| 3 | B | C | F | H |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A | B | ||||||
| D | E | F | |||||
| C | G | H |
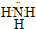
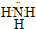
查看答案和解析>>
科目:高中化学 来源: 题型:
| 3 | 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)写出下列元素的元素符号:B________________,D_________________。
(2)E的最高价态与A、B、C形成酸式盐Y的化学式是___________,该盐在水溶液中的离子浓度由大到小的顺序是______________________。
(3)常温时,B元素的最高价氧化物对应水化物Z的溶液与盐X的溶液的pH均为a,这两种溶液中由水电离出来的H+浓度分别用c(H+)1、c(H+)2表示,则
c(H+)1∶c(H+)2=____________________。
(4)B的氢化物与水反应生成M的水溶液与D的最高价氧化物对应水化物N的水溶液均具有_______________(填“酸”或“碱”)性,为了证明M与N酸性或碱性的相对强弱,请你写出操作步骤、实验现象和实验结论:_____________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com