
【题目】已知乳酸的结构简式为 。试回答:
。试回答:
(1)乳酸分子中含有________和_________两种官能团(写名称)。
(2)乳酸与金属钠反应的化学方程式为______________________________________________。
(3)乳酸与Na2CO3溶液反应的化学方程式为_________________________________________。
 全程金卷系列答案
全程金卷系列答案科目:高中化学 来源: 题型:
【题目】药物阿司匹林可由水杨酸制得,它们的结构如图所示。有关说法正确的是

A.服用阿司匹林,身体出现水杨酸不良反应时,可静脉注射NaHCO3溶液
B.阿司匹林的分子式为C9H10O4
C.1 mol阿司匹林最多可消耗2 mol NaOH
D.水杨酸可以发生取代、加成、氧化、加聚反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F、G、H八种主族元素分布在三个不同的短周期,它们在周期表中位置如下:
A | ||||||
B | C[ | D | ||||
E | F | G | H | |||
请回答下列问题:
(1)写出E元素在周期表中的位置 。
(2)B与D可形成三原子分子X,X的电子式为 。
(3)E、F、H所形成的简单离子的半径由大到小的顺序为 (用离子符号表示)。
(4)G的最高价氧化物与B的单质在高温下能发生置换反应,其化学反应方程式为:
。
(5)由A、C、D三种元素组成的强电解质Z溶于水时能促进水的电离,测得Z的水溶液pH<7,其原因是 (用离子方程式来表示)。
(6)盐Y由B、D、E组成。以熔融盐Y为电解质构成的燃料电池如图所示。
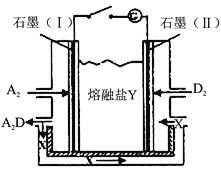
写出石墨(I)电极上发生的电极反应式 。
(7)用熔融盐Y的燃料电池作电源,以石墨为电极,电解一定浓度的CuSO4溶液至无色后继续电解一段时间。断开电路,向溶液中加入0.1 mol Cu(OH)2,溶液恢复到电解之前的体积和浓度,则电解过程中转移电子的物质的量为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上,向500-600℃的铁屑中通入氯气生产无水氯化铁;向炽热铁屑中通入氯化氢生产无水氯化亚铁。现用如图所示的装置模拟上述过程进行实验。

回答下列问题:
(1)制取无水氯化铁的实验中,A中反应的化学方程式为 ,当生成1molCl2时,转移的电子数为 ,玻璃丝的作用是 ,装置B中加入的试剂是 。装置D中加入的试剂是 。
(2)制取无水氯化亚铁的实验中,尾气的成分是 。若仍用D的装置进行尾气处理,存在的问题是 、 。
(3)若操作不当,制得的FeCl2会含有少量FeCl3杂质,下列说法中正确的是
A.检验FeCl3常用的试剂是KSCN溶液
B.可向固体混合物中加入适量Fe粉除去杂质
C.可向固体混合物中通入适量Cl2除去杂质
D.欲制得纯净的FeCl2,在实验操作中应先点燃A处的酒精灯,在点燃C处的酒精灯。
(4)现有一包FeCl2和FeCl3混合物,某化学兴趣小组为测定各成分的含量进行如下两个实验:
实验1:①称取一定质量的样品,将样品溶解;②向溶解后的溶液中加入足量的AgNO3溶液,产生沉淀;③将沉淀过滤、洗涤、干燥得到白色固体28.7g。
实验2:①称取与实验1中相同质量的样品,溶解;②加入足量的NaOH溶液,③将沉淀过滤、洗涤后,加热灼烧到质量不再减少,得到固体6.4g。则样品中FeCl3的物质的量为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:硫酸铜溶液中滴入氨基乙酸钠(H2N-CH2-COONa)即可得到配合物A。其结构如右图:
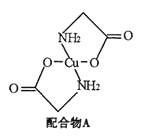
(1)Cu元素基态原子的外围电子排布图为 。
(2)配合物A中碳原子的轨道杂化类型为 。
(3)1mol氨基乙酸钠(H2N-CH2-COONa)含有![]() 键的数目为 。
键的数目为 。
(4)氨基乙酸钠分解产物之一为二氧化碳。写出二氧化碳的一种等电子体且为负一价阴离子: (写化学式)。
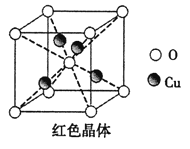
(5)已知:硫酸铜灼烧可以生成一种红色晶体,其结构如图,则该化合物的化学式是 。
(6)配合物A中元素C、H、N、O组成CH4和NO在400~500℃和Pt做催化剂下转化成无毒害物质,利用该反应可以控制机动车尾气排放。该反应方程式为
___________ ________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气在氯气中燃烧产生苍白色火焰。在反应过程中,破坏1 mol 氢气中的化学键消耗的能量为Q1kJ,破坏1 mol 氯气中的化学键消耗的能量为Q2KJ,形成1 mol 氯化氢中的化学键释放的能量为Q3kJ。下列关系式中正确的是
A.Q1 + Q2 >Q3 B.Q1 + Q2 >2Q3 C.Q1 + Q2 <Q3 D.Q1 + Q2 <2Q3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今年,雾霾阴影笼罩全国。二氧化硫、氮氧化物和可吸入颗粒物是雾霾的主要组成成分,综合治理其污染是环境化学当前的重要研究内容。
(1)汽车尾气中的 NO(g)和CO(g)在一定温度和催化剂的条件下可净化。发生的反应如下:2NO(g)+2CO(g)![]() 2CO2 (g)+N2 (g)
2CO2 (g)+N2 (g)
①已知:N2(g)+O2 (g)=2NO(g) ΔH=+180.0 kJ/mol。部分化学键的键能如下(键能指气态原子形成1mol化学键释放的最小能量)
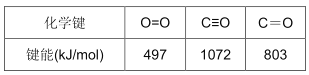
则反应:2NO(g)+2CO(g)![]() 2CO2 (g)+N2 (g) ΔH=__________ kJ/mol
2CO2 (g)+N2 (g) ΔH=__________ kJ/mol
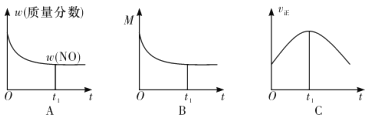
②若上述反应在绝热、恒容的密闭体系中进行,并在t1时刻达到平衡状态,则下列示意图不符合题意的是__________(填选项序号)。(图中 ω、M、v 正 分别表示质量分数、混合气体平均相对分子质量、正反应速率)
(2)尾气中的SO2可先催化氧化生成SO3,再合成硫酸。已知:2SO2(g)+O2 (g)![]() 2SO3(g) ΔH=-196.0 kJ/mol。
2SO3(g) ΔH=-196.0 kJ/mol。
①在一定温度的密闭容器中,SO2的转化率随时间的变化关系如图所示:
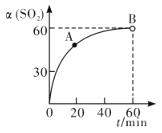
则A点的v逆(SO2 )__________(填―大于‖、―小于‖或―等于‖)B 点的 v正(SO2)。
②在某温度时,向10L的密闭容器中加入4.0 molSO2和10.0 molO2,反应达到平衡,改变下列条件,再次达到平衡时,能使O2的新平衡浓度和原来平衡浓度相同的是______(填选项序号)。
A.在其他条件不变时,减小容器的容积
B.保持温度和容器内压强不变,再充入2.0 mol SO2和5.0 mol O2
C.保持温度和容器体积不变,再充入SO2和SO3,使之浓度扩大为原来的两倍
(3)利用电化学原理,将NO2、O2和熔融KNO3 制成燃料电池,其原理如下图所示。
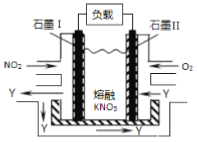
该电池在工作过程中NO2转变成绿色硝化剂Y,Y是一种氧化物,可循环使用。石墨Ⅱ是电池的____极,石墨Ⅰ附近发生的电极反应式为________________________。相同条件下,消耗的O2和NO2的体积比为_____。
(4)尾气中氮氧化物(NO和NO2 )也可用尿素[CO(NH2)2 ]溶液除去,反应生成对大气无污染的气体。1 mol 尿素能吸收工业尾气中氮氧化物(假设 NO、NO2体积比为 1∶1)的质量为___________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一个碳原子上如果连有3个氢原子,则这样的氢原子称为伯氢,如果只连有2个氢原子,则这样的氢称为仲氢,例如:-CH3中的氢原子为伯氢,-CH2-中的氢原子为仲氢。已知在烷烃中伯氢和仲氢被取代的活性因反应的条件不同而不同。在高温下伯氢与仲氢被取代的活性相等,则可以称之活性比为1︰1。请回答下列问题:
(1)已知丙烷在高温下与氯气发生取代反应,反应式如下:
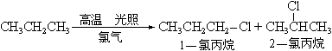
则在一氯代丙烷中1-氯丙烷在产物中的占有率为 ;
(2)常温下丙烷也能与氯气发生取代反应,反应式如下:

则在常温下伯氢和仲氢的相对活性比为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国科学家屠呦呦因青蒿素的研究荣获了2015年诺贝尔化学奖。青蒿素是继乙氨嘧啶、氯喹、伯喹之后最有效的抗疟特效药,具有速效和低毒的特点,曾被世界卫生组织称做是―世界上唯一有效的疟疾治疗药物‖。由青蒿素合成系列衍生物(它们的名称和代号如图所示)的路线如图:

回答下列问题:
(1)青蒿素的分子式为________;氢化青蒿素分子中官能团名称为______________。
(2)反应①中,有机反应类型为___________;NaBH4的作用是_______________。
A.氧化剂 B.还原剂 C.催化剂 D.溶剂
(3)有机物 D 是分子式为 C4H4O 3的五元环状化合物,请写出反应③的化学反应方程式
______________________________________________________。
(4)青蒿唬酯能够发生的反应类型有________。
A.酯化反应 B.水解反应 C.还原反应 D.加聚反应
(5)以H2Q 表示双氢青蒿素,写出反应②的化学方程式____________________________。
(6)从双氢青蒿素(H2Q)出发,可通过多步反应合成出有机物 E。合成过程中,有机原料除H2Q、![]() 外,还需含苯环的二羟基化合物F,写如有机物F与NaOH 溶液反应的离子反应方程式_____________________________________________,有机物G是F的同分异构体,有机物G遇FeCl3溶液显紫色,且有 4 种不同类型的氢,其个数比为3︰2︰2︰1,则符合条件的有机物G的同分异构体有_____种。
外,还需含苯环的二羟基化合物F,写如有机物F与NaOH 溶液反应的离子反应方程式_____________________________________________,有机物G是F的同分异构体,有机物G遇FeCl3溶液显紫色,且有 4 种不同类型的氢,其个数比为3︰2︰2︰1,则符合条件的有机物G的同分异构体有_____种。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com