
分析 ①铜片的稀盐酸中加入H2O2后,铜片溶解,发生氧化还原反应生成氯化铜、水,该反应中转移2e-;
②0.06 mol I-→0.02 mol I2+0.02 IO3-转移0.16 mol电子,由电子守恒计算参加反应的n(KMnO4);
③先由棕黄色变为浅绿色,过一会又变为棕黄色,则Fe3+先被还原后又氧化.
解答 解:①浸泡铜片的稀盐酸中加入H2O2后,铜片溶解,发生氧化还原反应生成氯化铜、水,反应的化学方程式为,故答案为:Cu+2HCl+H2O2=CuCl2+2H2O;
②0.06 mol I-→0.02 mol I2+0.02 IO3-转移0.16 mol电子,从MnO4-→Mn2+可以看出,化合价由+7价降低为+2价,由电子守恒可知参加反应的n(KMnO4)=$\frac{0.16mol}{(7-2)}$=0.032 mol,故答案为:0.032;
③先由棕黄色变为浅绿色,过一会又变为棕黄色,则Fe3+先被还原后又氧化,先变为浅绿色的离子方程式是2Fe3++SO32-+H2O=2Fe2++SO42-+2H+,后变为棕黄色的原因是H+与NO3-组成的硝酸将Fe2+氧化,故答案为:2Fe3++SO32-+H2O=2Fe2++SO42-+2H+.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念及分析应用能力的考查,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
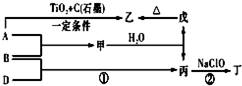 已知 A、B、D为中学常见的单质,甲、乙、丙、丁、戊为短周期元素组成的化合物.其中,丙是一种能使湿润的红色石蕊试纸变蓝的无色气体;丁是一种高能燃料,其组成元素与丙相同,1mol 丁分子中不同原子的数目比为1:2,且含有18mol电子;戊是一种难溶于水的白色胶状物质,既能与强酸反应,也能与强碱反应,具有净水作用.各物质间的转化关系如图所示(某些条件巳略去).
已知 A、B、D为中学常见的单质,甲、乙、丙、丁、戊为短周期元素组成的化合物.其中,丙是一种能使湿润的红色石蕊试纸变蓝的无色气体;丁是一种高能燃料,其组成元素与丙相同,1mol 丁分子中不同原子的数目比为1:2,且含有18mol电子;戊是一种难溶于水的白色胶状物质,既能与强酸反应,也能与强碱反应,具有净水作用.各物质间的转化关系如图所示(某些条件巳略去).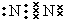 .写出丙的结构式
.写出丙的结构式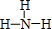 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol Cl2参加反应,转移的电子数一定为2NA | |
| B. | 常温常压下,23g NO2与N2O4的混合气体中氮原子数为0.5NA | |
| C. | 标准状况下,22.4L乙烯中含极性共价键数为4NA | |
| D. | 2L 0.1mol•L-1的HClO溶液中含有的H+离子数小于0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 取溶液进行焰色反应显黄色,一定含有Na+ | |
| B. | 滴加BaCl2溶液,产生白色沉淀,证明有SO42- | |
| C. | 滴加KSCN溶液,变为血红色,溶液中含Fe2+ | |
| D. | 加入稀盐酸产生无色气体,一定含有CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、K+、Cl-、F- | B. | Fe2+、ClO-、NO3-、Na+ | ||
| C. | Fe2+、Mg2+、SO42-、Cl- | D. | CO32-、SO42-、Na+、K+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有②③ | B. | ①②③ | C. | ②③④ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
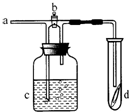 如图所示,从a处通入了氯气.若打开活塞b,d处的干燥有色布条不褪色,若关闭活塞b,d处的干燥有色布条褪色.下列判断正确的是( )
如图所示,从a处通入了氯气.若打开活塞b,d处的干燥有色布条不褪色,若关闭活塞b,d处的干燥有色布条褪色.下列判断正确的是( )| A. | c中盛放的不可能是NaCl溶液 | B. | c中盛放的可能是浓硫酸 | ||
| C. | c中盛放的可能是足量NaOH溶液 | D. | a处通入的是干燥的氯气 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com