
【题目】在实验室里制取乙烯,常因温度过高而使乙醇和浓硫酸反应生成少量的二氧化硫,有人设计下列实验如图以确认上述混合气体中有C2H4和SO2 . 回答下列问题: 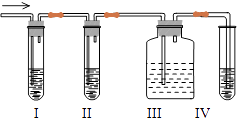
(1)Ⅰ、Ⅱ、Ⅲ、Ⅳ装置可盛放的试剂是:Ⅰ;Ⅱ;Ⅲ;Ⅳ(将下列有关试剂的序号填入空格内). A.品红溶液 B.NaOH溶液 C.浓硫酸 D.酸性KMnO4溶液
(2)能说明SO2气体存在的现象是 .
(3)使用装置Ⅱ的目的是 .
(4)使用装置Ⅲ的目的是 .
(5)确定含有乙烯的现象是 .
【答案】
(1)A;B;A;D
(2)装置Ⅰ中品红褪色
(3)除去二氧化硫以免干扰乙烯的检验
(4)检验二氧化硫是否被完全除去
(5)装置Ⅲ中品红不褪色,装置Ⅳ中高锰酸钾溶液褪色
【解析】解:(1)检验二氧化硫用品红溶液,检验乙烯用高锰酸钾酸性溶液,乙烯和二氧化硫都能使高锰酸钾酸性溶液褪色,所以先检验二氧化硫,然后检验乙烯,同在检验乙烯之前用NaOH溶液除尽SO2 , 再通过品红溶液不褪色确认SO2已除干净,最后用高锰酸钾酸性溶液褪色检验乙烯; 因装置Ⅰ用来检验SO2 , 试管中品红溶液褪色,说明含有SO2 , 装置Ⅱ试管装有NaOH溶液除去SO2 , 装置Ⅲ试管通过品红溶液不褪色确认SO2已除干净,装置Ⅳ通过高锰酸钾酸性溶液褪色检验乙烯,
故答案为:A;B;A;D;(2)装置I用来检验SO2 , 试管中品红溶液褪色,说明含有SO2 ,
故答案为:Ⅰ中品红溶液褪色;(3)装置Ⅱ试管装有NaOH溶液除去SO2 ,
故答案为:除去二氧化硫以免干扰乙烯的检验;(4)装置Ⅲ试管通过品红溶液不褪色确认SO2已除干净,
故答案为:检验二氧化硫是否被完全除去;(5)装置Ⅳ通过高锰酸钾酸性溶液褪色检验乙烯,
故答案为:Ⅲ中的品红不褪色,Ⅳ中的高锰酸钾溶液褪色.
(1)多种产物需检验时,应考虑先后顺序;(2)二氧化硫能漂白品红;(3)氢氧化钠能吸收二氧化硫;(4)品红溶液不褪色确认SO2已除干净;(5)Ⅲ中无二氧化硫,Ⅳ中与高锰酸钾溶液反应的是乙烯.


科目:高中化学 来源: 题型:
【题目】“足球烯”C60是一种外形类似足球状的分子,关于C60的说法错误的是( )
A.C60是一种新型的化合物B.C60的相对分子量为720
C.C60和金刚石互为同素异形体D.C60硬度比金刚石小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I、硬质玻璃管是化学实验中经常使用的一种仪器,分析下列实验并回答:
如图1所示,将浓硫酸滴入装有Na2SO3固体的培养皿一段时间后,a、b、c 三个棉球变化如下表(认为所产生的气体与棉球上的试剂均得到充分的反应)。则浓硫酸在该反应中表现的性质_________________;
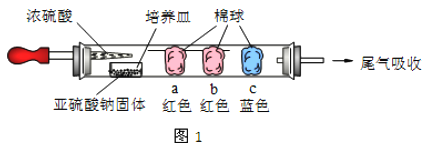
棉球 | 棉球上滴加试剂 | 实验现象 | 解释或结论 |
a | ___________ | 棉球变白,微热后又恢复红色 | 该气体具有______性。 |
b | 含酚酞的NaOH 溶液 | 棉球变为白色 | 离子方程式_________ |
c | __________ | 棉球变为白色 | 化学方程式___________,该气体具有_______性。 |
II.通常情况下,向硫酸亚铁溶液中滴加氢氧化钠溶液时,生成的白色絮状沉淀会迅速变为_____色,最终变为____色写出上述白色絮状沉淀变化过程的化学方程式_______;
用下面两种方法可以制得白色的Fe(OH)2沉淀。
方法一: 用不含O2的蒸馏水配制的NaOH 溶液与硫酸亚铁反应制备。
(1)除去蒸馏水中溶解的O2常采用_________的方法。
(2)生成白色Fe(OH)2 沉淀的操作是用长滴管吸取不含O2的NaOH 溶液,插入FeSO4溶液液面下,再挤出NaOH 溶液。
方法二: 如右图装置中,用NaOH 溶液、铁屑、稀H2SO4等试剂制备。
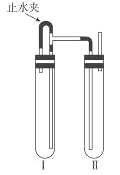
(1)在试管I里加入的试剂是___________。
(2)为了制得白色Fe(OH)2沉淀,在试管I和II中加入试剂,打开止水夹,塞紧塞子后,检验试管II出口处排出的氢气的纯度。当排出的氢气纯净时,再________(如何操作)。这样生成的Fe(OH)2 沉淀能较长时间保持白色。原因是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某气态烷烃与烯烃的混合气9g,其密度为相同状况下氢气密度的11.25倍,将混合气体通过足量的溴水,溴水增重4.2g,求:
(1)混合气体的平均摩尔质量为gmol﹣1 .
(2)下列关于混合气体组成,判断正确的是(填字母编号)
A.必有甲烷
B.必有乙烯
C.无法判断
(3)气态烯烃的物质的量mol.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化硒(SeO2)是一种氧化剂,其被还原后的单质硒可能成为环境污染物,通过与浓HNO3或浓H2SO4反应生成SeO2以回收Se。完成下列填空:
(1)Se和浓HNO3反应的还原产物为NO和NO2,且NO和NO2的物质的量之比为1∶1,写出Se和浓HNO3反应的化学方程式:_________________________________________。
(2)已知:Se+2H2SO4(浓)===2SO2↑+SeO2+2H2O;2SO2+SeO2+2H2O===Se+2SO![]() +4H+。SeO2、H2SO4(浓)、SO2的氧化性由强到弱的顺序是________________________。
+4H+。SeO2、H2SO4(浓)、SO2的氧化性由强到弱的顺序是________________________。
(3)回收得到的SeO2的含量,可以通过下面的方法测定:
①____SeO2+____I-+____H+===____Se+____I2+____H2O
②I2+2Na2S2O3===Na2S4O6+2NaI
配平化学方程式①,并标出电子转移的方向和数目。_____________
(4)实验中,准确称量SeO2样品0.150 0 g,消耗了0.200 0 mol·L-1的Na2S2O3溶液25.00 mL,所测样品中SeO2的质量分数为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关下列各装置图的叙述,不正确的是( )
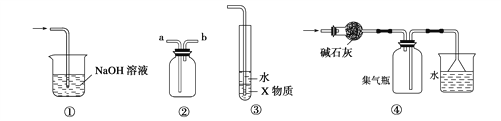
A. 装置①可用于吸收实验中多余的Cl2
B. 装置②可用于收集H2、NH3、Cl2、HCl、NO2等
C. 装置③中X为煤油,可用于吸收氨气或氯化氢
D. 装置④可用于收集氨气,并吸收多余的氨气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知H2A为二元弱酸,20℃时,配制一组c(H2A)+c(HA-)+c(A2-)=0.100mol/L的H2A和NaOH混合溶液,溶液中部分微粒的物质的量浓度随pH的变化曲线如图所示。下列说法错误的是
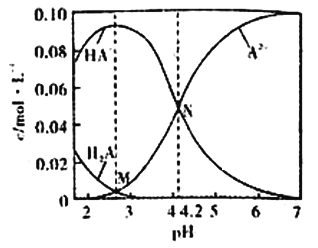
A. Ka2(H2A)的数量级为10-5
B. NaHA溶液中:c(H+)>c(OH-)
C. M点由水电离出的c(H+)>N点由水电离出的c(H+)
D. pH=7的溶液中:c(Na+)>2c(A2-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.质子核磁共振谱(PMR)是研究有机物结构的有力手段之一,在所研究的化合物分子中,每一结构中的等性氢原子在PMR谱中都给了相应的峰(信号),谱中峰的强度与结构中的H原子数成正比。例如,乙醛的结构式为CH3CHO,其PMR谱中有两个信号,其强度之比为3:1。已知有机物A的分子式为C4H8。
(1)若有机物A的PMR有4个信号,其强度之比为3:2:2:1,该有机物的名称为______。
(2)若该有机物PMR只有1个信号,则用结构简式表示为______。
II.“司乐平”是治疗高血压的一种临床药物,合成其有效成分的医药中间体为肉桂酸,其结构简式如图:![]() 。
。
(3)肉桂酸的分子式为_______,含有的含氧官能团名称为_______。
(4)一定条件下,1mol肉桂酸最多可与______molH2发生加成反应。
(5)肉桂酸的同分异构体,同时符合下列条件的结构简式为________。
①苯环上只有三个取代基
②能与新制氢氧化铜悬浊液反应生成砖红色物质
③质子核磁共振谐有4个信号,其强度之比为3:2:2:1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com