
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题

| A. | 该反应属于加成反应 | |
| B. | 水杨醛能被酸性高锰酸钾溶液氧化为水杨酸 | |
| C. | 可用新制的Cu(OH)2悬浊液区别水扬醛和香豆素 | |
| D. | 水杨醛、乙酸肝和香豆素都能发生水解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
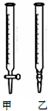 用0.1032mol•L-1 HCl溶液滴定未知浓度的NaOH溶液,
用0.1032mol•L-1 HCl溶液滴定未知浓度的NaOH溶液,| 滴定次数 | 待测溶液的体积(/mL) | 标准HCl溶液的体积 | |
| 滴定前读数(/mL) | 滴定后读数(/mL) | ||
| 1 | 25.00 | 1.02 | 21.04 |
| 2 | 25.00 | 2.00 | 22.98 |
| 3 | 25.00 | 0.20 | 20.18 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
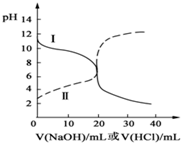 25℃时,取浓度均为0.1mol/L的醋酸溶液和氨水溶液各20mL,分别用0.1mol/LNaOH溶液、0.1mol/L盐酸进行中和滴定,滴定过程中,pH随着滴加溶液的体积变化如图所示.下列说法不正确的是( )
25℃时,取浓度均为0.1mol/L的醋酸溶液和氨水溶液各20mL,分别用0.1mol/LNaOH溶液、0.1mol/L盐酸进行中和滴定,滴定过程中,pH随着滴加溶液的体积变化如图所示.下列说法不正确的是( )| A. | 曲线Ⅱ:滴加溶液到10mL时:c(CH3COO-)>c(Na+)>c(H+)>c(OH-) | |
| B. | 曲线Ⅱ:滴加溶液到10mL时:c(CH3COO-)-c(CH3COOH)═2[c(OH-)-c(H+)] | |
| C. | 曲线Ⅰ:滴加溶液在10mL-20mL之间存在:c(Cl-)═c(NH4+)>c(OH-)═c(H+) | |
| D. | 曲线Ⅰ:滴加溶液到20mL时:c(Cl-)>c(NH4+)>c(H+)>c(NH3•H2O)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验 编号 | HA物质的量 浓度(mol•L-1) | NaOH物质的量 浓度(mol•L-1) | 混合溶 液的pH |
| ① | 0.1 | 0.1 | pH=9 |
| ② | c | 0.2 | pH=7 |
| ③ | 0.2 | 0.1 | pH<7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 试 管 | 未加MnSO4的试管 | 加有MnSO4的试管 |
| 褪色时间 | 30s | 2s |
| 试 管 | 未滴加稀硫酸的试管 | 滴加了稀硫酸的试管 |
| 褪色时间 | 100s | 90s |
| 试 管 | 滴入10滴稀硫酸的试管 | 加入1mL稀硫酸的试管 | 加入2mL稀硫酸的试管 |
| 褪色时间 | 70s | 100s | 120s |
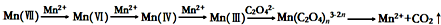
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 物质 | X | Y | Z |
| 初始浓度/mol•L-1 | 0.1 | 0.2 | 0 |
| 平衡浓度/mol•L-1 | 0.05 | 0.05 | 0.1 |
| A. | 反应达到平衡时,X的转化率为50% | |
| B. | 反应可表示为X(g)+3Y(g)?2Z(g),其平衡常数为1600 (L/mol)2 | |
| C. | 增大压强,平衡常数增大 | |
| D. | 改变温度可以改变此反应的平衡常数 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

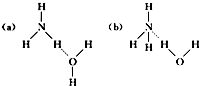
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com