
下列根据实验及现象得出的结论不正确的是
实 验 现 象 结论
A 
液体X 试管(1)中紫色消失,试管(2)中紫色没有消失 甲苯中苯环使甲基的活性增强
B 


 试管内壁有
试管内壁有
银镜生成 X具有还原性,一定含有醛基
C  先生成白色沉淀,滴加FeCl3溶液后,生成红褐色沉淀 Fe(OH)3是比Mg(OH)2
先生成白色沉淀,滴加FeCl3溶液后,生成红褐色沉淀 Fe(OH)3是比Mg(OH)2
更难溶的电解质
D  试管b 比试管a中溶液的红色深 增大反应物浓度,平衡向正反应方向移动
试管b 比试管a中溶液的红色深 增大反应物浓度,平衡向正反应方向移动
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:
| A、该溶液中一定存在的阴离子是SO32-、SO42-、I- | B、该溶液中可能存在的阴离子是CO32-、Cl- | C、步骤三中溶液变黄可能是因为生成了I2 | D、该溶液中可能存在的阳离子是Na+,可用焰色反应加以检验 |
查看答案和解析>>
科目:高中化学 来源:2010年厦门双十中学高三考前热身卷理科综合(化学) 题型:填空题
(15分)Ⅰ某研究性学习小组对过量炭粉与氧化铁反应的气体产物成分进行研究。
(1)提出假设:①该反应的气体产物是CO2。②该反应的气体产物是CO。③该反应的气体产物是 
(2)设计方案:如图所示,将一定量的氧化铁在隔绝空气的条件下与过量炭粉完全反应,测定参加反应的碳元素与氧元素的质量比。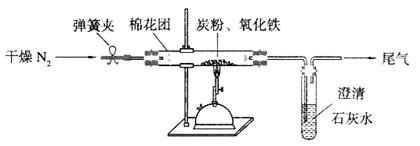
(3)查阅资料:氮气不与碳、氧化铁发生反应。实验室可以用氯化铵饱和溶液和亚硝酸钠(NaNO2)饱和溶液混合加热反应制得氮气。
①请写出该反应的离子方程式: 。
②下列装置可用于实验室制取氮气的是 。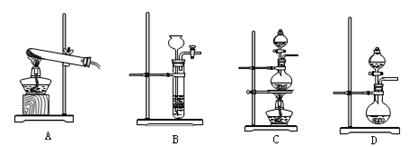
(4)实验操作及实验现象:
①按上图连接装置,并检查装置的气密性,称取3.20g氧化铁与2.00g炭粉混合均匀,放入48.48g的硬质玻璃管中;
②加热前,先通一段时间纯净干燥的氮气;
③停止通入N2后,夹紧弹簧夹,加热一段时间,澄清石灰水变浑浊;
④待反应结束,再通一段时间的氮气。冷却至室温,称得硬质玻璃管和固体总质量为52.24g。
(5)数据处理,经计算,参加反应的碳元素质量为0.48g,氧元素为0.96g。推断假设 成立。 该实验中发生的化学方程式为 。
该实验中发生的化学方程式为 。
(6)实验优化:根据实验得出的结论,应对该实验装置进一步完善,你认为应作如何改进? 。
Ⅱ由碳的氧化物直接合成甲醇、乙醇燃料已进入工业生产。如:
反应① CO(g)+2H2(g)  CH3OH(g)
CH3OH(g)
反应② 2CO(g)+4H2 (g) CH3CH2OH (g)+H2O (g)
CH3CH2OH (g)+H2O (g)
某同学为了寻找合成甲醇的适宜条件[温度、压强、碳氢比n(CO)/n(H2)、催化剂质量],设计了如下对比实验,部分实验条件已经填在下面实验设计表中(每次实验,反应时间相同)。
| 实验编号 | T(℃) | n (CO)/n(H2) | P(MPa) | CO转化率(%) |
| 1 | 150 | 1/3 | 0.1 | K^S*5U.C# |
| 2 | x | 1/3 | 5 | |
查看答案和解析>>
科目:高中化学 来源:炎德?英才大联考三湘名校2010届高三月考试卷(一) 题型:实验题
(每空2分,共12分)某校化学研究性学习小组的同学在学习了金属的知识后,为了解Cu的常见化合物性质,运用类比学习的思想提出 如下的问题,探究。请你协助该小组的同学完成下列研究。
如下的问题,探究。请你协助该小组的同学完成下列研究。
【提出问题】
①Cu的金属活泼性小于Al,Al(OH)3具有两性,Cu(OH)2也具有两性吗?
②通常情况下,+2价Fe的稳定性小于+3价Fe,+1价Cu的稳定性也小于+2价Cu吗?③CuO能被H2、CO等还原,也 能被NH3还原吗?
能被NH3还原吗?
【实验方案】
(1)解决问题①需用到的药品有:CuSO4溶液、_________(填试剂),同时进行相关实验。
(2)解决问题②的实验步骤和现象如下:取98g Cu(OH)2固体,加热至80℃~100℃时,得到黑色固体粉末,继续加热到1000℃以上,黑色粉末全部变成红色粉末A。冷却后称量A的质量为72g。向A中加入适量的稀硫酸,得到蓝色溶液,同时观察到容器还有红色固体存在。据些可推得,A的化学式为_____。
(3)为解决问题③,设计的实验装置为(夹持及尾气处理装置未画出):
实验中观察到CuO变为红色物质,无水CuSO4变____色。同时生成一种对大气无污染的气体。
【实验结论】
(1)Cu(OH)2具有两性,证明Cu(OH)2具有两性的实验现象应是____________________________________。
(2)根据“实验方案(2)”,得出的+1价Cu和+2价Cu稳定性大小的结论是__________________________________。
【问题讨论】
(1)有同学认为NH3与CuO反应生成的 红色物质是Cu,也有同学认为NH3与CuO反应生成的红色物质
红色物质是Cu,也有同学认为NH3与CuO反应生成的红色物质 是Cu和A的混合物。请你设计一个简单的实验检验NH3与CuO反应中生成的红色物质中是否含有A______________________________________________________。
是Cu和A的混合物。请你设计一个简单的实验检验NH3与CuO反应中生成的红色物质中是否含有A______________________________________________________。
查看答案和解析>>
科目:高中化学 来源:2014届湖北省宜昌市高二下学期期末考试化学试卷(解析版) 题型:实验题
为探究乙炔与溴的加成反应,甲同学设计并进行了如下实验:先取一定量工业用电石与水反应,将生成的气体通入溴水中,发现溶液褪色,即证明乙炔与溴水发生了加成反应。
乙同学发现在甲同学的实验中,褪色后的溶液里有少许淡黄色浑浊,推测在制得的乙炔中还可能含有少量还原性的杂质气体,由此他提出必须先除去之,再与溴水反应。
请你回答下列问题:
(1)写出甲同学实验中两个主要的化学方程式: __________________________ 、
_________________________________ 。
(2)根据甲同学设计的实验及现象不能证明是乙炔与溴发生了加成反应,其理由是 _______
(a)使溴水褪色的反应,未必是加成反应 (b)使溴水褪色的反应,就是加成反应
(c)使溴水褪色的物质,未必是乙炔 (d)使溴水褪色的物质,就是乙炔
(3)乙同学推测此乙炔中必定含有的一种杂质气体是 ,它与溴水反应的离子方程式是 ;在验证过程中必须全部除去。
(4)为验证此反应是加成而不是取代,丙同学用pH试纸来测试反应后溶液的酸性,理由是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com