
【题目】锌铜原电池装置如图所示,其中阳离子交换膜只允许阳离子和水分子通过,下列有关叙述正确的是

A. 铜电极上发生氧化反应
B. 电池工作一段时间后,甲池的c(SO42-)减小
C. 电池工作一段时间后,乙池溶液的总质量增加
D. 阴阳离子分别通过交换膜向负极和正极移动,保持溶液中电荷平衡
【答案】C
【解析】试题分析:A、由图像可知该原电池反应原理为Zn+Cu2+=Zn2++Cu,故Zn电极为负极失电子发生氧化反应,Cu电极为正极得电子发生还原反应,A错误;B、该装置中为阳离子交换膜只允许阳离子和水分子通过,故两池中c(SO42-)不变,B错误;C、电解过程中溶液中Zn2+由甲池通过阳离子交换膜进入乙池,乙池中Cu2++2e—=Cu,故乙池中为Cu2+~Zn2+,摩尔质量M(Zn2+)>M(Cu2+)故乙池溶液的总质量增加,C正确;D、该装置中为阳离子交换膜只允许阳离子和水分子通过,电解过程中溶液中Zn2+由甲池通过阳离子交换膜进入乙池保持溶液中电荷平衡,阴离子并不通过交换膜,D错误,故选C。


 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案科目:高中化学 来源: 题型:
【题目】不同元素的原子在分子内吸引电子的能力大小可用一定数值 x 来表示,若 x 越大,其原子吸引电子能力越强,在所形成的分子中成为带负电荷的一方。
下面是某些短周期元素的 x 值:
元素符号 | Li | Be | B | C | N | F |
x 值 | 0.98 | 1.57 | 2.04 | 2.25 | 2.89 | 3.98 |
元素符号 | Na | Mg | Si | P | S | Cl |
x 值 | 0.93 | 1.35 | 1.90 | 2.19 | 2.58 | 3.16 |
(1)通过分析 x 值变化规律,确定Al、N的 x 值范围:________< x (Al)<________
(2)推测 x 值与原子半径关系是________,根据短周期元素的 x 值变化特点,体现了元素性质的________变化规律。
(3)某有机化合物结构式为: ,其中SO键中你认为共用电子对偏向谁?________(写原子名称)。
,其中SO键中你认为共用电子对偏向谁?________(写原子名称)。
(4)经验规律告诉我们:当成键的两原子相应元素的 x 差值(Δ x )即 x >1.7时,一般为离子键;当Δ x <1.7时,一般为共价键。试推断AlF 3 中化学键类型是________。
(5)预测元素周期表中, x 值最小的元素的位置:_______(放射性元素除外)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在1200时,天然气脱硫工艺中会发生下列反应:
H2S(g)+3/2O2(g)=SO2(g)+H2O(g) △H1
2H2S(g)+SO2(g)=3/2S2(g)+2H2O(g) △H2
H2S(g)+1/2O2(g)=S(g)+H2O(g) △H3
2S(g)=S2(g) △H4
则△H4的正确表达式为
A. △H4= 2/3(△H1+△H2- 3△H3) B. △H4= 2/3(3△H3-△H1-△H2)
C. △H4= 3/2(△H1+△H2- 3△H3) D. △H4= 3/2(△H1-△H2- 3△H3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.1 mol/L的HCl溶液滴定a mL NaOH稀溶液,反应恰好完全时,消耗HCl溶液b mL,此时溶液中氢氧根离子的浓度c(OH-)是( )
A. 1×10-7 mol/L B. 1×107 mol/L C. 0.1mol/L D. 0.01 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,某溶液中水电离出的H+和OH-的物质的量浓度乘积为1×10-26,该溶液中一定不能大量存在的是( )
A. Cl- B. HCO3- C. Na+ D. NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】检测血液中的Ca2+能够帮助判断多种疾病。某研究小组测定血液样品中Ca2+的含量(l00mL血液中含Ca2+的质量),实验步骤如下:
①准确量取5.00mL血液样品,处理后配制成50.00mL溶液;
②准确量取溶液10.00mL,加入过量(NH4)2C2O4溶液,使Ca2+完全转化成CaC2O4沉淀;
③过滤并洗净所得CaC2O4沉淀,用过量稀硫酸溶解,生成H2C2O4和CaSO4稀溶液;
④加入12.00mL0.0010mol·L-1的KMnO4溶液,使H2C2O4完全被氧化,离子方程式为:2MnO4-+5H2C2O4+6H+=10CO2↑+2Mn2++8H2O;
⑤用0.0020mol·L-1 (NH4)2Fe(SO4)2溶液滴定过量的KMnO4溶液,消耗(NH4)2Fe(SO4)2溶液的体积如图所示,离子方程式为:MnO4-+5Fe2++8H+=5Fe3++Mn2++4H2O
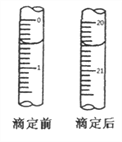
回答下列问题:
(1)已知H2C2O4属于二元弱酸,下列说法正确的是_________
A.H2C2O4 溶液中:c(H+)=c(HC2O4-)+ c(C2O42-)+ c(H2C2O4)
B.相同温度下,等物质的量浓度的(NH4)2C2O4和(NH4)2Fe(SO4)2溶液,c(NH4+)前者小于后者
C.(NH4)2C2O4 溶液中:c(NH4+)+c(NH3·H2O)=2c(HC2O4-)+2c(C2O42-)+ 2c(H2C2O4)
D.(NH4)2Fe(SO4)2溶液:c(SO42-)>c(NH4+)>c(Fe2+)>c(OH-)>c(H+)
(2)实验中发现向草酸溶液中逐滴加入酸性高锰酸钾溶液,溶液褪色开始时缓慢,一段时间后迅速加快,利用水浴使反应液保持恒温时也是如此,出现该现象的可能原因是_________
(3)12.00mL0.0010mol·L-1的KMnO4溶液应用_________量取(填“酸式”或“碱式”滴定管)
(4)到达滴定终点时的现象是_________
(5)若步骤⑤滴定管在使用前未用标准(NH4)2Fe(SO4)2溶液洗涤,测得血液中Ca2+的含量将_________ (填“偏高”、“偏低”或“无影响”)。
(6)计算血样中Ca2+的含量_________ g/100mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】要证明某溶液中不含Fe3+而可能含有Fe2+进行如下实验操作时,最佳顺序为( )
①加入足量氯水 ②加入足量KMnO4溶液 ③加入少量NH4SCN溶液.
A.①③
B.③②
C.③①
D.①②③
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com