
【题目】检测血液中的Ca2+能够帮助判断多种疾病。某研究小组测定血液样品中Ca2+的含量(l00mL血液中含Ca2+的质量),实验步骤如下:
①准确量取5.00mL血液样品,处理后配制成50.00mL溶液;
②准确量取溶液10.00mL,加入过量(NH4)2C2O4溶液,使Ca2+完全转化成CaC2O4沉淀;
③过滤并洗净所得CaC2O4沉淀,用过量稀硫酸溶解,生成H2C2O4和CaSO4稀溶液;
④加入12.00mL0.0010mol·L-1的KMnO4溶液,使H2C2O4完全被氧化,离子方程式为:2MnO4-+5H2C2O4+6H+=10CO2↑+2Mn2++8H2O;
⑤用0.0020mol·L-1 (NH4)2Fe(SO4)2溶液滴定过量的KMnO4溶液,消耗(NH4)2Fe(SO4)2溶液的体积如图所示,离子方程式为:MnO4-+5Fe2++8H+=5Fe3++Mn2++4H2O
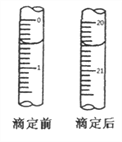
回答下列问题:
(1)已知H2C2O4属于二元弱酸,下列说法正确的是_________
A.H2C2O4 溶液中:c(H+)=c(HC2O4-)+ c(C2O42-)+ c(H2C2O4)
B.相同温度下,等物质的量浓度的(NH4)2C2O4和(NH4)2Fe(SO4)2溶液,c(NH4+)前者小于后者
C.(NH4)2C2O4 溶液中:c(NH4+)+c(NH3·H2O)=2c(HC2O4-)+2c(C2O42-)+ 2c(H2C2O4)
D.(NH4)2Fe(SO4)2溶液:c(SO42-)>c(NH4+)>c(Fe2+)>c(OH-)>c(H+)
(2)实验中发现向草酸溶液中逐滴加入酸性高锰酸钾溶液,溶液褪色开始时缓慢,一段时间后迅速加快,利用水浴使反应液保持恒温时也是如此,出现该现象的可能原因是_________
(3)12.00mL0.0010mol·L-1的KMnO4溶液应用_________量取(填“酸式”或“碱式”滴定管)
(4)到达滴定终点时的现象是_________
(5)若步骤⑤滴定管在使用前未用标准(NH4)2Fe(SO4)2溶液洗涤,测得血液中Ca2+的含量将_________ (填“偏高”、“偏低”或“无影响”)。
(6)计算血样中Ca2+的含量_________ g/100mL
【答案】 B C 反应生成的Mn2+催化了反应的进行,使褪色速率变快 酸式滴定管 最后一滴溶液滴下,锥形瓶中溶液颜色从浅紫色变成无色且半分钟内不变色 偏低 0.040
【解析】(1)A.根据质子守恒,H2C2O4 溶液中:c(H+)=c(HC2O4-)+ 2c(C2O42-)+ c(OH-) ,溶液显弱酸性,c(OH-)< c(H2C2O4),故A错误;B.相同温度下,等物质的量浓度的(NH4)2C2O4和(NH4)2Fe(SO4)2溶液,亚铁离子水解,抑制铵根离子的水解,c(NH4+)前者小于后者,故B正确;C.(NH4)2C2O4 溶液中存在物料守恒:c(NH4+)+c(NH3·H2O)=2c(HC2O4-)+2c(C2O42-)+ 2c(H2C2O4),故C正确;D.(NH4)2Fe(SO4)2溶液中,铵根离子浓度约为亚铁离子浓度的2倍,水解后溶液显酸性,故D错误;故选BC;
(2)实验中发现向草酸溶液中逐滴加入酸性高锰酸钾溶液,溶液褪色开始时缓慢,一段时间后迅速加快,出现该现象的原因可能是反应生成的Mn2+催化了反应的进行,使褪色速率变快,故答案为:反应生成的Mn2+催化了反应的进行,使褪色速率变快;
(3)高锰酸钾溶液具有强氧化性,能够腐蚀乳胶管,应该选用酸式滴定管盛放,故答案为:酸式;
(4)用(NH4)2Fe(SO4)2滴定过量的高锰酸钾时,腐蚀氧化还原反应,紫红色会褪去,到达滴定终点时,锥形瓶中溶液颜色从浅紫色变成无色且半分钟内不变色,故答案为:最后一滴溶液滴下,锥形瓶中溶液颜色从浅紫色变成无色且半分钟内不变色;
(5)若步骤⑤滴定管在使用前未用标准(NH4)2Fe(SO4)2溶液洗涤,导致溶液体积偏大,剩余的高锰酸钾偏多,使得测得的草酸偏多,与血液中Ca2+反应的草酸偏少,钙离子含量偏低,故答案为:偏低;
(6)KMnO4的总物质的量为:0.0010 molL-1×12×10-3L=1.2×10-5mol,(NH4)2Fe(SO4)2溶液滴定消耗的过量的KMnO4的物质的量为:0.0020 molL-1×20.00×10-3L×![]() =8.0×10-6mol,与H2C2O4反应的KMnO4的量为:1.2×10-5mol-8.0×10-6mol=4.0×10-6mol,n(H2C2O4)=4.0×10-6mol×
=8.0×10-6mol,与H2C2O4反应的KMnO4的量为:1.2×10-5mol-8.0×10-6mol=4.0×10-6mol,n(H2C2O4)=4.0×10-6mol×![]() =1.0×10-5mol,n(CaC2O4)=1.0×10-5mol,所以100mL血样中Ca2+的含量为:1.0×10-5mol×40gmol-1×
=1.0×10-5mol,n(CaC2O4)=1.0×10-5mol,所以100mL血样中Ca2+的含量为:1.0×10-5mol×40gmol-1×![]() ×
×![]() =0.04g,故答案为:0.04g。
=0.04g,故答案为:0.04g。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】锌铜原电池装置如图所示,其中阳离子交换膜只允许阳离子和水分子通过,下列有关叙述正确的是

A. 铜电极上发生氧化反应
B. 电池工作一段时间后,甲池的c(SO42-)减小
C. 电池工作一段时间后,乙池溶液的总质量增加
D. 阴阳离子分别通过交换膜向负极和正极移动,保持溶液中电荷平衡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:2CrO![]() +2H+Cr2O
+2H+Cr2O![]() +H2O。某科研小组用如图电解装置,由Na2CrO4溶液制取Na2Cr2O7溶液。下列有关叙述正确的是( )
+H2O。某科研小组用如图电解装置,由Na2CrO4溶液制取Na2Cr2O7溶液。下列有关叙述正确的是( )

A.CrO![]() 生成Cr2O
生成Cr2O![]() 的反应为非氧化还原反应,不能通过电解方法获得
的反应为非氧化还原反应,不能通过电解方法获得
B.a为电源正极
C.d口流出的NaOH溶液的浓度与c口通入的NaOH溶液的浓度相同
D.Na+从右侧通过阳离子交换膜进入左侧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NaOH溶液吸收烟气中的SO2,将所得的Na2SO3溶液进行电解,可循环再生NaOH,同时得到H2SO4,其原理如图所示(电极材料为石墨)。下列有关叙述不正确的是
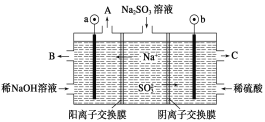
A.图中a极连接电源的负极
B.A口放出的物质是氢气,C口放出的物质是氧气
C.b极电极反应式为:SO32--2e-+H2O===SO42-+2H+
D.电解过程中阴极区碱性明显增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子一定能大量共存的是( )
A.在无色溶液中:Na+、Fe2+、Cl﹣、SO42﹣
B.在酸性溶液中:NH4+、Ca2+、NO3﹣、HCO3﹣
C.在碱性溶液中:K+、Ba2+、SO42﹣、NO3﹣
D.在含大量Mg2+的溶液中:Na+、NH4+、SO42﹣、Cl﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解装置如图所示,电解槽内装有KI及淀粉溶液,中间用阴离子交换膜隔开。在一定的电压下通电后,发现左侧溶液变蓝色,一段时间后,蓝色又逐渐变浅。(已知:3I2+ 6OH—= IO3—+5I—+3H2O , IO3—离子无色);下列说法不正确的是

A.右侧发生的电极反应式:2H2O+2e—= H2↑+2OH-
B.a为电源正极
C.电解结束时,右侧溶液中没有IO3—
D.用阴离子交换膜,电解槽内发生的总化学方程式为:KI + 3H2O ![]() KIO3+3H2↑
KIO3+3H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A.某醋酸溶液的pH=a,将此溶液稀释1倍后,溶液的pH=b,则a>b
B.在滴有酚酞的氨水里,加入NH4Cl至溶液恰好无色,则此时溶液的pH<7
C.常温下,1.0×10-3 mol·L-1盐酸的pH=3.0,1.0×10-8 mol·L-1盐酸的pH=8.0
D.常温下,若1 mL pH=1的盐酸与100 mL NaOH溶液混合后,溶液的pH=7,则NaOH溶液的pH=11
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com