
【题目】黑火药爆炸的反应为:2KNO3+3C+S=K2S+N2↑+3CO2↑,则被还原的元素是( )
A.碳和氮
B.氮和硫
C.只有氮
D.只有硫
科目:高中化学 来源: 题型:
【题目】下列各组物质按照单质、氧化物、酸、碱、盐分类顺序排列,其中正确的是( )
A.水银、干冰、硫酸、烧碱、纯碱
B.碘酒、冰、硝酸、苛性钠、胆矾
C.氢气、二氧化硫、盐酸、纯碱、硫酸铜
D.铜、氧化铜、醋酸、熟石灰、石灰石
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】不同元素的原子在分子内吸引电子的能力大小可用一定数值 x 来表示,若 x 越大,其原子吸引电子能力越强,在所形成的分子中成为带负电荷的一方。
下面是某些短周期元素的 x 值:
元素符号 | Li | Be | B | C | N | F |
x 值 | 0.98 | 1.57 | 2.04 | 2.25 | 2.89 | 3.98 |
元素符号 | Na | Mg | Si | P | S | Cl |
x 值 | 0.93 | 1.35 | 1.90 | 2.19 | 2.58 | 3.16 |
(1)通过分析 x 值变化规律,确定Al、N的 x 值范围:________< x (Al)<________
(2)推测 x 值与原子半径关系是________,根据短周期元素的 x 值变化特点,体现了元素性质的________变化规律。
(3)某有机化合物结构式为: ,其中SO键中你认为共用电子对偏向谁?________(写原子名称)。
,其中SO键中你认为共用电子对偏向谁?________(写原子名称)。
(4)经验规律告诉我们:当成键的两原子相应元素的 x 差值(Δ x )即 x >1.7时,一般为离子键;当Δ x <1.7时,一般为共价键。试推断AlF 3 中化学键类型是________。
(5)预测元素周期表中, x 值最小的元素的位置:_______(放射性元素除外)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】凯里一中2018届高一(1)班的两名同学用酸碱中和滴定的方法测定烧碱溶液的浓度。过程如下:
①将碱式滴定管用蒸馏水洗净后,用待测溶液润洗后,再注入待测溶液,调节滴定管的尖嘴部分充满溶液,并使液面处于"0"刻度以下的位置,记下读数;将锥形瓶用蒸馏水洗净后,用待测溶液润洗锥形瓶2~3次;从碱式滴定管中放入20.00mL待测溶液到锥形瓶中。
②将酸式滴定管用蒸馏水洗净后,立即向其中注入0.1000mol/L标准硫酸,调节滴定管的尖嘴部分充满溶液,并使液面处于"0"刻度以下的位置,记下读数。
③向锥形瓶中滴入酚酞作指示剂,进行滴定。滴定至指示剂刚好变色,且30秒内颜色不再改变为止,测得所耗硫酸的体积为V1mL。
④重复以上过程,但在滴定过程中向锥形瓶加入5mL蒸馏水,测得所耗盐酸为V2mL。
试回答下列问题:
(1)滴定时边滴边摇动锥形瓶,眼睛应观察______________;
A.滴定管内液面的变化 B.锥形瓶内溶液颜色的变化
(2)锥形瓶中的溶液从_______色变为_______色时,且30秒种不变化,停止滴定。
(3)该小组在步骤中①错误是______________,由此造成的测定结果分别是_______,(填偏高、偏低或无影响)。
(4)步骤②缺少的操作是______________________。
(5)如下图,是某次滴定时的滴定管中的液面,则其读数为_______mL。

(6)根据下列数据

请计算待测烧碱溶液的浓度为______________mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下0.1mol·L-1亚硫酸溶液中 H2SO3、HSO3-、SO32-三种微粒所占物质的量分数(a)随pH变化的关系如图所示。下列说法不正确的是( )

A. 由图中数据可计算得到常温下亚硫酸溶液的Ka2
B. 在0.1mol·L-1H2SO3溶液中,存在:c2(H+)=c(H+)·c(HSO3-)+2c(H+)·c(SO32-)+Kw
C. 向pH为7的溶液中滴入少量稀盐酸造成的溶液pH变化小于向pH为4.0的溶液中滴入相同量稀盐酸造成的溶液pH变化
D. 在pH=2.0溶液中:c(H2SO3)>c(HSO3-)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有机物中,能发生消去反应生成2种烯烃(不考虑顺反异构),又能发生水解反应的是
A. 2-溴丁烷 B. 3-乙基-3-氯戊烷
C. 2,2-二甲基-1-氯丁烷 D. 1,3-二氯苯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在1200时,天然气脱硫工艺中会发生下列反应:
H2S(g)+3/2O2(g)=SO2(g)+H2O(g) △H1
2H2S(g)+SO2(g)=3/2S2(g)+2H2O(g) △H2
H2S(g)+1/2O2(g)=S(g)+H2O(g) △H3
2S(g)=S2(g) △H4
则△H4的正确表达式为
A. △H4= 2/3(△H1+△H2- 3△H3) B. △H4= 2/3(3△H3-△H1-△H2)
C. △H4= 3/2(△H1+△H2- 3△H3) D. △H4= 3/2(△H1-△H2- 3△H3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】检测血液中的Ca2+能够帮助判断多种疾病。某研究小组测定血液样品中Ca2+的含量(l00mL血液中含Ca2+的质量),实验步骤如下:
①准确量取5.00mL血液样品,处理后配制成50.00mL溶液;
②准确量取溶液10.00mL,加入过量(NH4)2C2O4溶液,使Ca2+完全转化成CaC2O4沉淀;
③过滤并洗净所得CaC2O4沉淀,用过量稀硫酸溶解,生成H2C2O4和CaSO4稀溶液;
④加入12.00mL0.0010mol·L-1的KMnO4溶液,使H2C2O4完全被氧化,离子方程式为:2MnO4-+5H2C2O4+6H+=10CO2↑+2Mn2++8H2O;
⑤用0.0020mol·L-1 (NH4)2Fe(SO4)2溶液滴定过量的KMnO4溶液,消耗(NH4)2Fe(SO4)2溶液的体积如图所示,离子方程式为:MnO4-+5Fe2++8H+=5Fe3++Mn2++4H2O
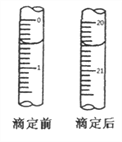
回答下列问题:
(1)已知H2C2O4属于二元弱酸,下列说法正确的是_________
A.H2C2O4 溶液中:c(H+)=c(HC2O4-)+ c(C2O42-)+ c(H2C2O4)
B.相同温度下,等物质的量浓度的(NH4)2C2O4和(NH4)2Fe(SO4)2溶液,c(NH4+)前者小于后者
C.(NH4)2C2O4 溶液中:c(NH4+)+c(NH3·H2O)=2c(HC2O4-)+2c(C2O42-)+ 2c(H2C2O4)
D.(NH4)2Fe(SO4)2溶液:c(SO42-)>c(NH4+)>c(Fe2+)>c(OH-)>c(H+)
(2)实验中发现向草酸溶液中逐滴加入酸性高锰酸钾溶液,溶液褪色开始时缓慢,一段时间后迅速加快,利用水浴使反应液保持恒温时也是如此,出现该现象的可能原因是_________
(3)12.00mL0.0010mol·L-1的KMnO4溶液应用_________量取(填“酸式”或“碱式”滴定管)
(4)到达滴定终点时的现象是_________
(5)若步骤⑤滴定管在使用前未用标准(NH4)2Fe(SO4)2溶液洗涤,测得血液中Ca2+的含量将_________ (填“偏高”、“偏低”或“无影响”)。
(6)计算血样中Ca2+的含量_________ g/100mL
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com