
【题目】煤化工中常需研究不同温度下平衡常数、投料比及产率等问题。
已知CO(g)+H2O(g)![]() H2(g)+CO2(g)的平衡常数随温度的变化如下表:
H2(g)+CO2(g)的平衡常数随温度的变化如下表:

试回答下列问题:
(1)上述反应的正反应是________反应(填“放热”或“吸热”)。
(2)某温度下,上述反应达到平衡后,保持容器体积不变升高温度,逆反应速率________(填“增大”、“减小”或“不变”),容器内混合气体的压强________(填“增大”、“减小”或“不变”)。
(3)830℃时,在恒容反应器中发生上述反应,按下表中的物质的量投入反应混合物,其中向逆反应方向进行的有______(选填字母).

(4)在830℃时,在2 L的密闭容器中加入4 mol CO(g)和6 mol H2O(g)达到平衡时,H2(g)的体积分数是__________。
【答案】 放热 增大 增大 AC 24%
【解析】(1)根据表中数据可知,温度升高平衡常数减小,说明平衡向逆反应方向移动,则正反应放热,故答案为:放热;
(2)温度升高,反应速率增大,平衡向逆反应方向移动,反应前后气体体积不变,等容容器中压强之比等于温度之比,所以压强增大,故答案为:增大;增大;
(3)根据830℃时,平衡常数k=1计算;
A、Q= (2×3)÷(5×1)=1.2>1,反应向逆反应方向移动,故A正确;
B、Q= (2.4×1.5)÷(2×2)=0.9<1,反应向正反应方向移动,故B错误;
C、Q= (3.2×2.5)÷(3.5×2)=1.14>1,反应向逆反应方向移动,故C正确;
D、Q= (0.5×2)÷(1×1)=1,达到平衡状态,平衡不移动,故D错误。
(4)830℃时,在2L的密闭容器中加入4molCO(g)和6molH2O(g)达到平衡时,设一氧化碳转化物质的量为x,依据平衡三段式列式得到
CO(g)+H2O(g)![]() H2(g)+CO2(g)
H2(g)+CO2(g)
起始量(mol): 4 6 0 0
变化量(mol): x x x x
平衡量(mol):4-x 6-x x x
平衡常数K= x2÷(4-x)×(6-x)=1 x=2.4mol
H2的体积分数= 2.4 ÷(1.6+3.6+2.4+2.4)×100%=24% 。


科目:高中化学 来源: 题型:
【题目】 X、Y、Z、W四种物质在一定条件下具有如图所示的转化关系,下列判断正确的是
![]()
A.若图中反应均为非氧化还原反应,当W为一元强碱时,则X可能是NaAlO2
B.若图中反应均为非氧化还原反应,当W为一元强酸时,则X可能是NH3
C.若图中反应均为氧化还原反应,当W为非金属单质时,则Z可能是CO2
D.若图中反应均为氧化还原反应,当W为金属单质时,则Z可能是FeCl3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 1 mol 金刚石晶体中,平均含有1 mol C—C键
B. BCl3中B原子以sp2杂化,分子为平面三角形
C. 氢键具有方向性和饱和性,也属于一种化学键
D. (HO)2RO3的酸性比(HO)2RO2弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
化合物G是治疗高血压的药物“比索洛尔”的中间体,一种合成G的路线如下:

已知以下信息:
①A的核磁共振氢谱为单峰;B的核磁共振氢谱为三组峰,峰面积比为6∶1∶1。
②D的苯环上仅有两种不同化学环境的氢;1molD可与1mol NaOH或2mol Na反应。
回答下列问题:
(1)A的结构简式为____________。
(2)B的化学名称为____________。
(3)C与D反应生成E的化学方程式为____________。
(4)由E生成F的反应类型为____________。
(5)G是分子式为____________。
(6)L是D的同分异构体,可与FeCl3溶液发生显色反应,1mol的L可与2mol的Na2CO3反应,L共有______种;其中核磁共振氢谱为四组峰,峰面积比为3∶2∶2∶1的结构简式为___________、____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)N、H两元素按原子数目比l∶3和2∶4构成分子A和B,A的中心原子的杂化方式是________,A的电子式为____________,B的结构式为____________。
(2)NO3-的空间构型为________ ;写出NO3-互为等电子体的一种分子的化学式______。
(3)铅、钡、氧形成的某化合物的晶胞结构是:Pb4+处于立方晶胞顶点,Ba2+处于晶胞中心,O2-处于晶胞棱边中心,该化合物化学式为______,每个Ba2+与_____个O2-配位。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。
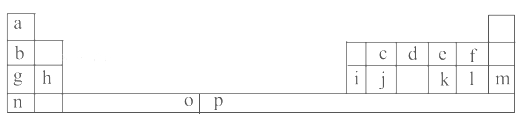
试回答下列问题:
(1)元素p为26号元素,请写出其原子的三价阳离子的电子排布式:______________。
(2)e与a反应的产物的分子中中心原子的杂化形式为__________,该分子是__________(填“极性”或“非极性”)分子。
(3)请写出f的氢化物在水中所存在氢键的表达式:(任写两种即可)_________________________。
(4)o、p两元素的部分电离能数据列于下表:
元素 | o | p | |
电离能 /kJ·mol-1 | I1 | 717 | 759 |
I2 | 1 509 | 1 561 | |
I3 | 3 248 | 2 957 | |
比较两元素的I2、I3可知,气态o2+再失去一个电子比气态p2+再失去一个电子难。对此,你的解释是___________________________________;
(5)i单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示。
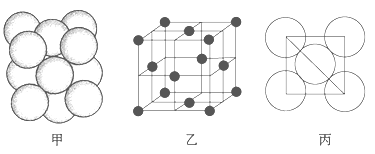
请问晶胞中i原子的配位数为________,一个晶胞中i原子的数目为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】全固态锂硫电池能量密度高、成本低,其工作原理如图所示,其中电极 a常用掺有石墨烯的S8材料,电池反应为:16Li+xS8=8Li2Sx(2≤x≤8)。下列说法错误的是( )

A. 电池工作时,正极可发生反应:2Li2S6+2Li++2e-=3Li2S4
B. 电池工作时,外电路中流过 0.02 mol 电子,负极材料减重 0.14 g
C. 石墨烯的作用主要是提高电极a的导电性
D. 电池充电时间越长,电池中Li2S2的量越多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素A、B、C、D、E在元素周期表中的相对位置如图所示,其中D原子的质子数是其M层电子数的三倍,下列说法不正确的是 ( )

A. A有5种正价,与B可形成6种化合物
B. 工业上常通过电解熔融态C2B3的方法来获得C的单质
C. 简单离子的半径由大到小为:E>A>B>C
D. D、E两元素形成的化合物每种原子最外层都达到了8e-稳定结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能正确表达下列反应的离子方程式为
A. 用醋酸除去水垢:2H++CaCO3=Ca2++CO2↑+H2O
B. 硫化亚铁与浓硫酸混合加热:2H++FeS=H2S↑+ Fe2+
C. 向硫酸铝溶液中滴加碳酸钠溶液:2Al3++3![]() =Al2(CO3)3↓
=Al2(CO3)3↓
D. 用氢氧化钠溶液吸收工业废气中的NO2:2NO2+2OH-=![]() +
+![]() + H2O
+ H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com