
【题目】研究化学反应中的能量变化有重要意义。请根据学过的知识回答下列问题:

(1)已知一氧化碳与水蒸气反应过程的能量变化如图所示:反应的热化学方程式为________________。
(2)化学反应可视为旧键断裂和新键形成的过程。化学键的键能是形成(或拆开)1mol化学键时释放(或吸收)的能量。已知:N≡N键的键能是948.9kJ·mol-1,H-H键的键能是436.0kJ·mol-1,N-H键的键能是391.55kJ·mol-1,则1/2N2(g)+3/2H2(g)![]() NH3(g) ΔH =______________。
NH3(g) ΔH =______________。
(3)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行推算。
已知:①C(s,石墨)+O2(g)=CO2(g) ΔH1=akJ·mol-1,②2H2(g)+O2(g)=2H2O(l) ΔH2=bkJ·mol-1,③2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) ΔH3=ckJ·mol-1,298K时反应2C(s,石墨)+H2(g)=C2H2(g)的焓变:ΔH =_______________。
(4)已知:铝热反应是放热反应,又知,常温下:4Al(s)+3O2(g)=2Al2O3(s) ΔH1,4Fe(s)+3O2(g)=2Fe2O3(s) ΔH2,下面关于ΔH1、ΔH2的比较正确的是________
ΔH 1>ΔH 2 B.ΔH 1<ΔH 2 C.ΔH 1=ΔH 2 D.无法计算
【答案】CO(g)+H2O(g)=CO2(g)+H2(g) ΔH=-41kJ·mol-1-46.2kJ·mol-1(2a + 0.5b —0.5c)kJ·mol-1B
【解析】
(1)根据图像可知反应热=-41kJ/mol,所以反应的热化学方程式为CO(g)+H2O(g)=CO2(g)+H2(g)△H=-41 kJ/mol;故答案为:CO(g)+H2O(g)=CO2(g)+H2(g) ΔH=-41kJ·mol-1;
(2)反应热=反应物中键能之和-生成物中键能之和,则1/2N2(g)+3/2H2(g)===NH3(g)△H=0.5×948.9kJ/mol+1.5×436.0 kJ/mol-3×391.55 kJ/mol=-46.2 kJ/mol。故答案为:-46.2kJ·mol-1;
(3)已知:①C(s,石墨)+O2(g)=CO2(g)△H1=akJmol-1;②2H2(g)+O2(g)=2H2O (l)△H2=bkJmol-1;③2C2H2(g)+5O2(g)═4CO2(g)+2H2O (l)△H2=ckJmol-1;2C(s,石墨)+H2(g)=C2H2(g)的反应可以根据①×2+②×1/2-③×1/2得到,所以反应焓变△H=2×a+b×1/2-c×1/2=(2a + 0.5b —0.5c)kJ·mol-1;故答案为:(2a + 0.5b —0.5c)kJ·mol-1;
(4)4Al(s)+3O2(g)═2Al2O3(s)△H1 ① 4Fe(s)+3O2(g)═2Fe2O3(s)△H2 ② 由盖斯定律①-②,得:4Al(s)+2Fe2O3═2Al2O3(s)+4Fe(s)△H1 -△H2,铝热反应为放热反应,即△H1 -△H2<0,所以△H1<△H2,则选B;故答案为:B。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列实验中没有用到玻璃棒的是( )
A.配制100mL0.2molL-1NaOH溶液
B.食盐的精制
C.浓硫酸的稀释
D.Fe(OH)3胶体的制备
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电解质溶液的说法不正确的是
A. 向0.1 mol·L-1CH3COOH溶液中加入少量水,溶液中![]() 增大
增大
B. 将CH3COONa溶液从20 ℃升温至30 ℃,溶液中![]() 减小
减小
C. 向盐酸中加入氨水至中性,溶液中![]() =1
=1
D. 向AgCl、AgBr的饱和溶液中加入少量AgNO3,溶液中![]() 变小
变小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下,下列说法正确的是
A. 等体积CH4和HF所含的电子数相同
B. pH=12的Na2CO3溶液中c(OH-)=1×10-2 mol/L
C. 2.4 g Mg与足量的盐酸反应,放出的气体体积为2.24 L
D. 由H2O2制2.24 L O2转移的电子数目为0.4 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中进行反应2SO2+O2![]() 2SO3,反应达平衡的标志是
2SO3,反应达平衡的标志是
①单位时间内消耗2 mol SO2的同时生成2 mol SO3
②反应混合物中,SO2、O2与SO3的物质的量之比为2∶1∶2
③反应混合物中,SO3的质量分数不再改变
A. ①②B. ①③C. ①D. ③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 稳定性:HCl<HBr
B. 氯化钠和冰熔化时,化学键都被破坏
C. H2O2是既含极性键又含非极性键的共价化合物
D. NaOH、NH4Cl、H2SO4在水中均能电离出离子,它们都是离子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将等物质的量的A、B混合于2L的密闭容器中,发生如下反应:3A(g)+B(g)![]() xC(g)+2D(g),经5min后,测得D的浓度为0.5mol/L,c(A):c(B)=3:5,C的平均反应速率为0.1 mol/(Lmin),试求:(1)x的值_______;
xC(g)+2D(g),经5min后,测得D的浓度为0.5mol/L,c(A):c(B)=3:5,C的平均反应速率为0.1 mol/(Lmin),试求:(1)x的值_______;
(2)5min时A的浓度_______;
(3)此5min内B的转化率_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有 0.175 mol·L-1醋酸钠溶液500 mL,(已知室温下,醋酸的电离平衡常数Ka=1.75×10-5)。
⑴ 写出醋酸钠水解反应的化学方程式______________________________;
⑵ (双选)下列图象能说明醋酸钠的水解反应达到平衡的是____________;
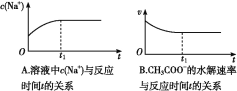
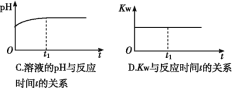
⑶ (双选)向醋酸钠溶液中加入少量下列物质,水解平衡向正向移动的有______;
A.冰醋酸 B.纯碱固体 C.醋酸钠固体 D.氯化铵固体
⑷ (双选)在醋酸钠溶液中加入冰醋酸,溶液中微粒浓度的关系式能成立的有__________;
A.c(CH3COO-) + c(CH3COOH) > c(Na+)
B.c(Na+) > c(CH3COO-) > c(H+) > c(OH-)
C.c(CH3COO-) > c(Na+) > c(H+) > c(OH-)
D.c(CH3COO-) > c(H+) > c(OH-) > c(Na+)
⑸ 欲配制0.175 mol·L-1醋酸钠溶液500 mL,可采用以下两种方案:
方案一:用托盘天平称取___________g无水醋酸钠,溶于适量水中,配成500 mL溶液。[已知:M(CH3COONa) = 82g/mol ]
方案二:用体积均为250 mL且浓度均为___________mol·L-1的醋酸与氢氧化钠两溶液混合而成(设混合后的体积等于混合前两者体积之和)。
⑹ 在室温下,0.175 mol·L-1醋酸钠(CH3COONa)溶液的pH约为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将NO2装入带有活塞的密闭容器中,当反应2NO2(g)![]() N2O4(g)达到平衡后,改变下列一个条件,下列叙述正确的是
N2O4(g)达到平衡后,改变下列一个条件,下列叙述正确的是
A. 升高温度,气体颜色加深,则此反应为吸热反应
B. 慢慢压缩气体体积,平衡向正反应方向移动,混合气体的颜色变浅
C. 慢慢压缩气体体积,若体积减小一半,压强增大,但小于原来的两倍
D. 恒温恒容时,充入稀有气体,压强增大,平衡向正反应方向移动,混合气体的颜色变浅
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com