
【题目】现有 0.175 mol·L-1醋酸钠溶液500 mL,(已知室温下,醋酸的电离平衡常数Ka=1.75×10-5)。
⑴ 写出醋酸钠水解反应的化学方程式______________________________;
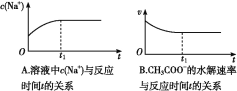
⑵ (双选)下列图象能说明醋酸钠的水解反应达到平衡的是____________;
⑶ (双选)向醋酸钠溶液中加入少量下列物质,水解平衡向正向移动的有______;
A.冰醋酸 B.纯碱固体 C.醋酸钠固体 D.氯化铵固体
⑷ (双选)在醋酸钠溶液中加入冰醋酸,溶液中微粒浓度的关系式能成立的有__________;
A.c(CH3COO-) + c(CH3COOH) > c(Na+)
B.c(Na+) > c(CH3COO-) > c(H+) > c(OH-)
C.c(CH3COO-) > c(Na+) > c(H+) > c(OH-)
D.c(CH3COO-) > c(H+) > c(OH-) > c(Na+)
⑸ 欲配制0.175 mol·L-1醋酸钠溶液500 mL,可采用以下两种方案:
方案一:用托盘天平称取___________g无水醋酸钠,溶于适量水中,配成500 mL溶液。[已知:M(CH3COONa) = 82g/mol ]
方案二:用体积均为250 mL且浓度均为___________mol·L-1的醋酸与氢氧化钠两溶液混合而成(设混合后的体积等于混合前两者体积之和)。
⑹ 在室温下,0.175 mol·L-1醋酸钠(CH3COONa)溶液的pH约为__________。
【答案】(1)CH3COONa +H2O![]() CH3COOH+NaOH
CH3COOH+NaOH
(2)BC(选1个给1分,见错不给分)
(3)CD
(4)AC
(5)7.2(答7.175的给1分),0.35mol/L(无单位给1分)
(6)9
【解析】
试题(1)醋酸钠水解生成醋酸和氢氧化钠,化学方程式为CH3COONa +H2O![]() CH3COOH+NaOH
CH3COOH+NaOH
(2)A、钠离子不水解,所以浓度始终不变,错误;B、醋酸根离子开始时水解速率最大,后逐渐减小,平衡时不在变化,正确;C、随着水解的逐渐进行,pH逐渐增大,平衡时不在变化,正确;D、KW是一温度常数,温度不变,KW不变,错误,答案选BC。
(3)A、加入冰醋酸溶液中醋酸浓度增大,平衡左移,错误;B、加入纯碱固体,对平衡体系的离子浓度无影响,平衡不移动,错误;C、加入醋酸钙固体,溶液在醋酸根离子浓度增大,平衡右移,正确;D、加入氯化铵固体,铵根离子与水解生成的氢氧根离子结合成一水合氨,使溶液中氢氧根离子浓度减小,平衡右移,正确,答案选CD。
(4)A、加入冰醋酸,使醋酸根离子浓度增大,但钠离子浓度不变,所以A正确;B、加入少量冰醋酸,平衡左移,醋酸根离子浓度增大,大于钠离子浓度,错误;C、加入冰醋酸,当溶液中醋酸浓度较大时,醋酸的电离大于醋酸根离子的水解程度,醋酸根离子浓度增大,溶液呈酸性,正确;D、无论是否电离程度大于水解程度,都不会存在c(OH-)>c(Na+),错误,答案选AC。
(5)有m=nM得醋酸钠的质量为7.175g,所以托盘天平称量的质量为7.2g;醋酸与氢氧化钠等浓度等体积混合,混合后的溶液浓度减半为0.175mol/L,所以原来的浓度为0.35mol/L
(6) 醋酸根的水解反应的平衡常数
K=Kw/Ka(CH3COOH)=c(CH3COOH)c(OH-)/c(CH3COO-)= c(OH-)2/c(CH3COO-),所以c(OH-)=10-5,Ph=9


科目:高中化学 来源: 题型:
【题目】最近湖南都市台报道,长沙市周边农田由于焚烧稻草导致烟雾弥漫,致使高速公路限行,航班停飞。烟雾属于下列分散系中的
A. 溶液 B. 悬浊液 C. 乳浊液 D. 胶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究化学反应中的能量变化有重要意义。请根据学过的知识回答下列问题:

(1)已知一氧化碳与水蒸气反应过程的能量变化如图所示:反应的热化学方程式为________________。
(2)化学反应可视为旧键断裂和新键形成的过程。化学键的键能是形成(或拆开)1mol化学键时释放(或吸收)的能量。已知:N≡N键的键能是948.9kJ·mol-1,H-H键的键能是436.0kJ·mol-1,N-H键的键能是391.55kJ·mol-1,则1/2N2(g)+3/2H2(g)![]() NH3(g) ΔH =______________。
NH3(g) ΔH =______________。
(3)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行推算。
已知:①C(s,石墨)+O2(g)=CO2(g) ΔH1=akJ·mol-1,②2H2(g)+O2(g)=2H2O(l) ΔH2=bkJ·mol-1,③2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) ΔH3=ckJ·mol-1,298K时反应2C(s,石墨)+H2(g)=C2H2(g)的焓变:ΔH =_______________。
(4)已知:铝热反应是放热反应,又知,常温下:4Al(s)+3O2(g)=2Al2O3(s) ΔH1,4Fe(s)+3O2(g)=2Fe2O3(s) ΔH2,下面关于ΔH1、ΔH2的比较正确的是________
ΔH 1>ΔH 2 B.ΔH 1<ΔH 2 C.ΔH 1=ΔH 2 D.无法计算
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,盐酸与氢氧化钠溶液相互滴定的滴定曲线如下图,下列叙述不正确的是
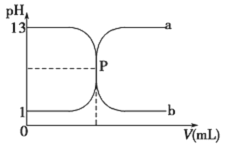
A. 滴定过程的任何时刻都存在:c(H+)+ c(Na+)=c(OH-)+c(Cl-)
B. 曲线b是用氢氧化钠溶液滴定盐酸溶液的滴定曲线
C. 氢氧化钠溶液的物质的量浓度为0.1molL-1
D. P点时恰好完全中和,溶液呈中性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇被称为2l世纪的新型燃料,工业上通过下列反应Ⅰ和Ⅱ,用CH4和H2O为原料来制备甲醇。
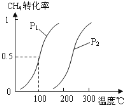
⑴①将1.0 mol CH4和2.0 mol H2O(g)通入容积100L的反应室,一定条件下发生反应:CH4(g) + H2O(g) CO(g) + 3H2(g)
Ⅰ,CH4的转化率与温度、压强的关系如图。已知100℃时达到平衡所需的时间为5min,则用H2表示的平均反应速率为:_____________;
②图中的压强P1_________P2(填“大于”、“小于”或“等于”),100℃时的平衡常数为:_______;
③在其它条件不变的情况下降低温度,逆反应速率将__________(填“增大”、“减小”或“不变”)。
⑵在压强为0.1 MPa条件下, 将a mol CO与 3amol H2的混合气体在催化剂作用下能自发反应生成甲醇:CO(g) + 2H2(g) CH3OH(g)
Ⅱ。①若容器容积不变,下列措施可提高甲醇产率的是:________________;
A.升高温度 B.将CH3OH(g)从体系中分离
C.充入He,使体系总压强增大 D.加入更高效的催化剂
②为了寻找合成甲醇的适宜温度和压强,某同学设计了三组实验,部分实验条件已经填在下面实验设计的表中,请帮他完成该表。
实验编号 | T(℃) | n (CO)/n(H2) | P(MPa) |
A | 150 | 1/3 | 0.1 |
B | Ⅰ | Ⅱ | 5 |
C | 350 | 1/3 | Ⅲ |
表中Ⅰ、Ⅱ、Ⅲ分别为:__________、____________、____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应既是氧化还原反应,又是吸热反应的是
A. 灼热的炭与CO2反应 B. 氧化铁与铝反应
C. 钠与乙醇反应 D. Ba(OH)2·8H2O与NH4C1反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知25℃、101 kPa下,如下图所示,石墨的燃烧热为一393.51 kJ·mol-1,金刚石的燃烧热为一395.4kJ·mol-1。下列表达正确的是

A. 金刚石比石墨稳定
B. C(s、石墨)=C(s、金刚石) △H=+1.9 kJ/mol
C. △H1<△H2
D. 如果使用催化剂,△H1和△H2都变小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是氧化镁和氯化镁的熔、沸点数据:请参考以上数据分析,从海水中提取镁,正确的方法是( )
物质 | 氧化镁 | 氯化镁 |
熔点/℃ | 2852 | 714 |
沸点/℃ | 3600 | 1410 |
A. 海水![]() Mg(OH)2
Mg(OH)2![]() Mg
Mg
B. 海水![]() MgCl2溶液
MgCl2溶液![]() MgCl2晶体
MgCl2晶体![]() Mg
Mg
C. 海水![]() Mg(OH)2
Mg(OH)2![]() MgO
MgO![]() Mg
Mg
D. 海水![]() Mg(OH)2
Mg(OH)2![]() MgCl2溶液
MgCl2溶液![]() MgCl2(熔融)
MgCl2(熔融) ![]() Mg
Mg
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应速率是通过实验测定的,下列化学反应速率的测量中,测量依据不可行的是( )
选项 | 化学反应 | 测量依据(单位时间内) |
A | 2NO2 | 颜色深浅 |
B | Zn+H2SO4=ZnSO4+H2 | H2体积 |
C | CO(g)+H2O(g)=CO2(g)+H2(g) | 压强变化 |
D | Ca(OH)2+Na2CO3=CaCO3↓+2NaOH | 沉淀质量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com