
【题目】化学反应速率是通过实验测定的,下列化学反应速率的测量中,测量依据不可行的是( )
选项 | 化学反应 | 测量依据(单位时间内) |
A | 2NO2 | 颜色深浅 |
B | Zn+H2SO4=ZnSO4+H2 | H2体积 |
C | CO(g)+H2O(g)=CO2(g)+H2(g) | 压强变化 |
D | Ca(OH)2+Na2CO3=CaCO3↓+2NaOH | 沉淀质量 |
科目:高中化学 来源: 题型:
【题目】(2014·江苏化学,14,4分)25 ℃时,下列有关溶液中微粒的物质的量浓度关系正确的是(双选)( )
A.0.1 mol·L-1 CH3COONa溶液与0.1 mol·L-1HCl溶液等体积混合:c(Na+)=c(Cl-)>c(CH3COO-)>c(OH-)
B.0.1 mol·L-1NH4Cl溶液与0.1 mol·L-1氨水等体积混合(pH>7):c(NH3·H2O)>c(NH![]() )>c(Cl-)>c(OH-)
)>c(Cl-)>c(OH-)
C.0.1 mol·L-1Na2CO3溶液与0.1 mol·L-1NaHCO3溶液等体积混合:![]() c(Na+) =c(CO
c(Na+) =c(CO![]() )+c(HCO
)+c(HCO![]() )+c(H2CO3)
)+c(H2CO3)
D.0.1 mol·L-1Na2C2O4溶液与0.1 mol·L-1HCl溶液等体积混合(H2C2O4为二元弱酸):2c(C2O![]() )+c(HC2O
)+c(HC2O![]() )+c(OH-)=c(Na+)+c(H+)
)+c(OH-)=c(Na+)+c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知以下信息:①1 mol N2的共价键断裂吸收946 kJ的能量;1 mol H2的共价键断裂吸收436 kJ的能量;形成1 mol NH3中的化学键释放1 173 kJ的能量。②将一定量的N2和H2投入一密闭容器中,在一定条件下进行反应,测得有关数据如下:
N2(mol·L-1) | H2(mol·L-1) | NH3(mol·L-1) | |
起始时 | 3 | 3 | 0 |
2s末 | 2.6 | 1.8 | 0.8 |
根据以上相关数据回答问题:
(1)用H2表示该反应2 s内的平均反应速率为________
(2)______(填“能”或“不能”)确认该反应2 s末已达化学平衡状态。
(3)写出该反应的化学方程式:
________________________________________________________________________。
(4)氮气和氢气生成氨气的过程______(填“释放”或“吸收”)能量。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.高纯度氢氧化镁广泛应用于医药、电力等领域。镁硅酸盐矿石可用于生产氢氧化镁,简要工艺流程如图所示:
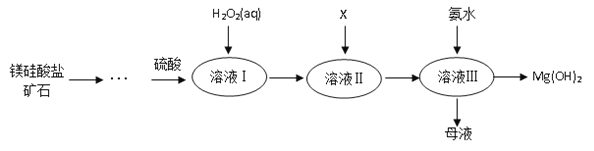
已知:
①溶液Ⅰ中除含Mg2+、SO42外,还含有少量Fe3+、Al3+、Fe2+等离子;
②常温下,几种金属离子开始沉淀和沉淀完全时的pH如下表所示:
金属离子 | Fe3+ | Al3+ | Fe2+ | Mg2+ |
开始沉淀时的pH | 1.5 | 3.3 | 6.5 | 9.4 |
沉淀完全时的pH | 3.7 | 5.2 | 9.7 | 12.4 |
请回答下列问题:
(1)镁在元素周期表中的位置_______________;
(2)向溶液Ⅱ中加入试剂X是_____________,作用是_________________________;
(3)流程中不加H2O2引起的后果是___________________________________;
(4)说出母液的一种用途___________________;
(5)加入H2O2溶液发生反应的离子方程式是___________________;
Ⅱ.海水中含有丰富的镁资源。某同学设计了从模拟海水中制备MgO的实验方案:
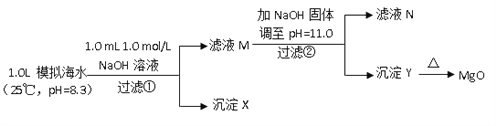
模拟海水中的离子浓度/ (mol/L) | Na+ | Mg2+ | Ca2+ | Cl- | HCO3- |
0.439 | 0.050 | 0.011 | 0.560 | 0.001 |
注:溶液中某种离子的浓度小于1.0×10-5mol/L,可认为该离子不存在;实验过程中,假设溶液体积不变。
已知:Ksp(CaCO3)=4.96×10-9;Ksp(MgCO3)=6.82×10-6;Ksp [Ca(OH)2]=4.68×10-6;Ksp [Mg(OH)2]=5.61×10-12。请回答下列问题:
(6)沉淀物X为_____________;
(7)滤液N中Ca2+浓度为_______________;
(8)加NaOH固体调整pH=12.5是否可行______(填“是”“否”);原因是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中药药剂砒霜(主要成分As2O3,微溶于水)在医疗上用于治疗急性白血病。某课题组以一种含砷精矿石粉(主要成份为As4S4、As2S3、FeS2及其它惰性杂质)为原料制取As2O3, 工艺流程简图如下:

回答下列问题:
(1)过程I中所得SO2气体可回收再利用,下列有关SO2用途的说法正确的是______。
A.工业制硫酸 B.漂白纸张 C.自来水消毒
(2)过程II中发生的反应______氧化还原反应(填“是”或“不是”)。
(3)过程V中系列操作为_______ (填化学实验基本操作名称)。
(4)①过程I中焙烧As2S3的化学反应方程式为_______________。
②过程IV中生成As2O3的离子反应方程式为_______________。
(5)有毒的AsO33-通过电解反应可转化为无毒的AsO43-。用石墨为电极,在强碱性溶液中
电解含AsO33-的溶液,阳极的电极反应式为______________。
(6)测定某As2O3粗产品(含As2O5杂质)中As2O3的质量分数的实验过程如下:
a.称取m g粗产品溶解于NaOH溶液,得到含AsO33-、AsO43-的混合溶液l00mL。
b.分别移取25.00mL上述溶液,用0.02500 mol·L-1的I2标准溶液进行滴定(I2将AsO33-氧化为AsO43-,淀粉溶液为指示剂)。每次滴定开始时液面读数如图一所示,三次滴定结束时,I2标准溶液液面读数如图二图四所示。
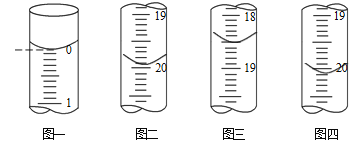
①描述滴定终点的现象_____________________。
②粗产品中As2O3的质量分数为______________ (用含有m的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】间溴苯甲醛(![]() ),是香料、染料、有机合成中间体,常温比较稳定,高温易被氧化。相关物质的沸点如下(101kPa)。
),是香料、染料、有机合成中间体,常温比较稳定,高温易被氧化。相关物质的沸点如下(101kPa)。
物质 | 沸点/℃ | 物质 | 沸点/℃ |
溴 | 58.8 | 1,2-二氯乙烷 | 83.5 |
苯甲醛 | 179 | 间溴苯甲醛 | 229 |
其实验室制备步骤如下:
步骤1:将三颈瓶中的一定配比的无水AlCl3、1,2-二氯乙烷和苯甲醛充分混合后,升温至60℃,缓慢滴加经浓硫酸干燥过的液溴,保温反应一段时间,冷却。
步骤2:将反应混合物缓慢加入一定量的稀盐酸中,搅拌、静置、分液。有机相用10%NaHCO3溶液洗涤。
步骤3:经洗涤的有机相加入适量无水MgSO4固体,放置一段时间后过滤。
步骤4:减压蒸馏有机相,收集相应馏分。(实验装置见下图)

(1)仪器A的名称为___________________,1,2-二氯乙烷的电子式为__________;
(2)实验装置中冷凝管的主要作用是________,进水口为____(填“a”或“b”);
(3)步骤1反应方程式为____________________;为吸收尾气锥形瓶中的溶液应为________,反应的离子方程式为________________;
(4)水浴加热的优点是__________________________;
(5)步骤2中用10%NaHCO3溶液洗涤有机相,是为了除去溶于有机相的______(填化学式);
(6)步骤4中采用减压蒸馏技术,是为了防止_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 共价化合物中可能含有离子键
B. Ca2+、K+、Cl-、S2-四种离子的半径依次减小
C. ![]() Po、
Po、![]() Po、
Po、![]() Po三种原子的核外电子数分别为124、125、126
Po三种原子的核外电子数分别为124、125、126
D. ⅥA族元素氧、硫、硒(Se)的位置从上至下,故H2O、H2S、H2Se稳定性依次减弱
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com