
【题目】化合物物G是一种用于合成γ-分泌调节剂的药物中间体,其合成路线流程图如下:
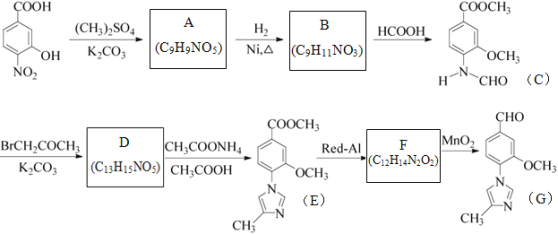
已知:![]()
请回答:
(1)B的结构简式为___________________。
(2)下列说法正确的是__________________。
A.化合物A能与FeCl3溶液发生显色反应
B.1mol化合物C最多能与2molNaOH反应
C.化合物E既有氧化性,又有还原性
D.由流程可知,Red-Al、MnO2分别做还原剂、氧化剂,其中MnO2也可用Cu/O2、足量的酸性高锰酸钾等代替
E.化合物G的最简式为C6H6NO
(3)C→D的过程中有一种无色无味气体产生,其化学方程式为____________________。
(4)写出同时满足下列条件的B的同分异构体的结构简式____________________。
①含有苯环,且分子中有一个手性碳原子;
②能发生水解反应,水解产物之一是α-氨基酸,另一水解产物分子中只有2种不同化学环境的氢。
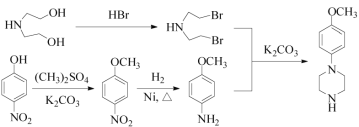
(5)已知: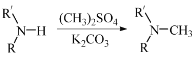 (R代表烃基,R'代表烃基或H)。请写出以
(R代表烃基,R'代表烃基或H)。请写出以![]() 、
、![]() 和(CH3)2SO4为原料制备
和(CH3)2SO4为原料制备![]() 的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干) _________。
的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干) _________。
【答案】 BCE2
BCE2 +2
+2![]() +
+![]() → 2
→ 2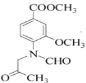 +2KBr+H2O+CO2↑
+2KBr+H2O+CO2↑![]()
【解析】
由合成流程可知,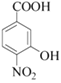 和A的分子式可知,二者相差C2H4,结合反应条件可知,
和A的分子式可知,二者相差C2H4,结合反应条件可知, →A为取代反应,A为
→A为取代反应,A为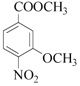 ,A→B发生还原反应,则B为
,A→B发生还原反应,则B为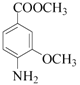 ,B→C为取代反应,生成C和水,根据已知信息,C→D为氨基上H被取代,D为
,B→C为取代反应,生成C和水,根据已知信息,C→D为氨基上H被取代,D为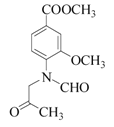 ,比较E与G的结构可知,F为
,比较E与G的结构可知,F为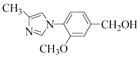 ,F→G发生氧化反应。
,F→G发生氧化反应。
(1)根据上述分析,B为 ,故答案为:
,故答案为: ;
;
(2) A.化合物A为 ,结构中没有酚羟基,不能与FeCl3溶液发生显色反应,错误;B.1mol化合物C(
,结构中没有酚羟基,不能与FeCl3溶液发生显色反应,错误;B.1mol化合物C(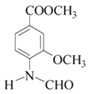 )中含有1mol酯基和1mol肽键,最多能与2molNaOH反应,正确;C.化合物E(
)中含有1mol酯基和1mol肽键,最多能与2molNaOH反应,正确;C.化合物E(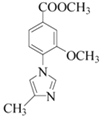 )中含有碳碳双键和苯环,能够与氢气发生还原反应,也能在空气中燃烧,因此既有氧化性,又有还原性,正确;D.由上述分析可知,Red-Al、MnO2分别做还原剂、氧化剂,其中MnO2也可用Cu/O2,但不能用酸性高锰酸钾代替,酸性高锰酸钾能够将醇氧化为酸,错误;E.化合物G(
)中含有碳碳双键和苯环,能够与氢气发生还原反应,也能在空气中燃烧,因此既有氧化性,又有还原性,正确;D.由上述分析可知,Red-Al、MnO2分别做还原剂、氧化剂,其中MnO2也可用Cu/O2,但不能用酸性高锰酸钾代替,酸性高锰酸钾能够将醇氧化为酸,错误;E.化合物G(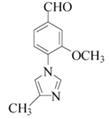 )的化学式为C12H12N2O2,的最简式为C6H6NO,正确;故选BCE;
)的化学式为C12H12N2O2,的最简式为C6H6NO,正确;故选BCE;
(3)C→D的过程中有一种无色无味气体产生,该气体应该为二氧化碳,反应的方程式为2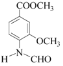 +2
+2![]() +
+![]() → 2
→ 2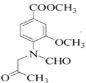 +2KBr+H2O+CO2↑,故答案为:2
+2KBr+H2O+CO2↑,故答案为:2 +2
+2![]() +
+![]() → 2
→ 2 +2KBr+H2O+CO2↑;
+2KBr+H2O+CO2↑;
(4) B为 ,①含有苯环,且分子中有一个手性碳原子;②能发生水解反应,水解产物之一是α-氨基酸,说明结构中含有酯基或肽键,另一水解产物分子中只有2种不同化学环境的氢,同时满足条件的B的同分异构体为
,①含有苯环,且分子中有一个手性碳原子;②能发生水解反应,水解产物之一是α-氨基酸,说明结构中含有酯基或肽键,另一水解产物分子中只有2种不同化学环境的氢,同时满足条件的B的同分异构体为![]() ,故答案为:
,故答案为:![]() ;
;
(5)以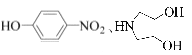 和(CH3)2SO4为原料制备
和(CH3)2SO4为原料制备![]() ,结合上述合成流程可知,-OH转化为-Br,酚-OH转化为醚键,硝基转化为氨基,最后发生信息中的反应,则合成流程为
,结合上述合成流程可知,-OH转化为-Br,酚-OH转化为醚键,硝基转化为氨基,最后发生信息中的反应,则合成流程为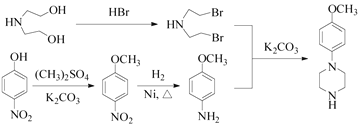 ,故答案为:
,故答案为: 。
。


 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案科目:高中化学 来源: 题型:
【题目】对工业废水和生活污水进行处理是防止水体污染、改善水质的主要措施之一。
(1)硫酸厂的酸性废水中砷(As)元素(主要以H3AsO3形式存在)含量极高,为控制砷的排放,某工厂采用化学沉淀法处理含砷废水。请回答以下问题:
①已知砷是氮的同族元素,比氮原子多2个电子层,砷在元素周期表的位置为____________。
②工业上采用硫化法(通常用硫化钠)去除废水中的砷,生成物为难溶性的三硫化二砷,该反应的离子方程式为_____________________。
(2)电镀厂的废水中含有的CN-有剧毒,需要处理加以排放。处理含CN-废水的方法之一是在微生物的作用下,CN-被氧气氧化成HCO3-,同时生成NH3,该反应的离子方程式为_____________。
(3)电渗析法处理厨房垃极发酵液,同时得到乳酸的原理如图所示(图中“HA”表示乳酸分子,A-表示乳酸根离子):
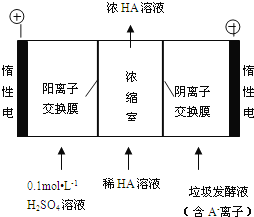
①阳极的电极反应式为________________________。
②简述浓缩室中得到浓乳酸的原理:________________________。
③电解过程中,采取一定的措施可控制阳极室的pH约为6~8,此时进入浓缩室的OH-可忽略不计。400 mL 10 g/L 乳酸溶液通电一段时间后,浓度上升为145 g/L(溶液体积变化忽略不计),阴极上产生的H2在标准状况下的体积约为________L(提示:乳酸的摩尔质量为90 g/mol)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。
a | |||||||||||||||||
b | c | d | e | f | |||||||||||||
g | h | i | j | k | l | m | |||||||||||
n | o | p | |||||||||||||||
试回答下列问题:
(1)元素p为26号元素,请写出其基态原子外围电子排布式:____。
(2)c与a形成6个原子组成分子结构简式:__________,该分子是:_______(填“极性”或“非极性”)分子。
(3)表中O、P两元素的部分电离能数据列于下表:
元 素 | O | P | |
电离能kJ·mol-1 | I1 | 717 | 759 |
I2 | 1509 | 1561 | |
I3 | 3248 | 2957 | |
比较两元素的I2、I3可知,气态O2+再失去一个电子比气态P2+再失去一个电子难。对此,你的解释是__________________________;
(4)i单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示。
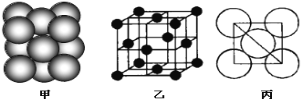
晶胞中i原子的配位数为___________,一个晶胞中i原子的数目为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W 为四种常见元素,其中 X、Y、Z 为短周期元素。ZX4分子是由粗Z提纯Z的中间产物,X的最高价氧化物对应的水化物为无机酸中的最强酸,Y的离子在同周期中离子半径最小,其氧化物有两性且可用于制造一种极有前途的高温材料,Z是无机非金属材料的主角,其单质是制取大规模集成电路的主要原料,W原子的最外层电子数小于4且W的常见化合价有+3、+2,WX3 的稀溶液呈黄色,回答下列问题:
(1)X在元素周期表的位置________________,其简单阴离子的结构示意图为____________________,用电子式表示X的氢化物的形成过程______________________________。
(2)Z的氧化物在通讯领域用来作_______________。锗与Z是同一主族元素,它可用来制造半导体晶体管。研究表明:有机锗具有明显的抗肿瘤活性,锗不与 NaOH溶液反应但在有 H2O2 存在时可与NaOH溶液反应生成锗酸盐,反应的化学方程式为:_______________________________
(3)W(OH)2 在空气中不稳定,极易被氧化,由白色迅速变成灰绿色,最后变成红褐色,反应的化学方程式为:____________________________________,若灼烧W(OH)2 固体得到___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究化学反应时,既要考虑物质变化与能量变化,也要关注反应的快慢与限度。回答下列问题:
(1)某温度时,在2 L容器中A、B两种物质间的转化反应中,A、B物质的量随时间变化的曲线如下图所示,由图中数据分析得:(A、B均为气体)
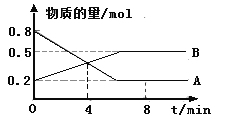
①该反应的化学方程式为____________________;
②反应开始至4 min时,B的平均反应速率为________ ;
③4 min时,反应是否达到平衡状态?________(填“是”或“否”),8 min时,v(正)________v(逆)(填“>”、“<”或“=”)。
(2)固定和利用CO2能有效地利用资源,并减少空气中的温室气体。工业上有一种用CO2来生产甲醇燃料的方法:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g)。某科学实验将6molCO2和8molH2充入2L的密闭容器中,测得H2的物质的量随时间变化如图曲线Ⅱ所示。a,b,c,d,e括号内数据表示坐标.
CH3OH(g)+H2O(g)。某科学实验将6molCO2和8molH2充入2L的密闭容器中,测得H2的物质的量随时间变化如图曲线Ⅱ所示。a,b,c,d,e括号内数据表示坐标.
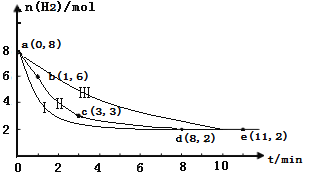
①a—b,b—c,c—d,d—e四段中,平均反应速率最大的时间段是___________ ,该时间段内CO2的平均反应速率是________。
②若在反应中加入了催化剂,则反应过程将变为图中的曲线_____ (填“Ⅰ”或“Ⅱ”或“Ⅲ”)。
③平衡时CO2的转化率是_________;反应前后容器内的压强比是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以氯酸钠(NaClO3)等为原料制备亚氯酸钠(NaClO2)的工艺流程如下,下列说法中,不正确的是
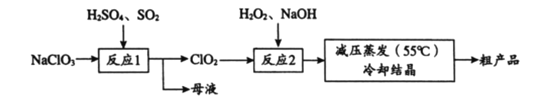
A. 反应1中,每生成1 mol ClO2有0.5 mol SO2被氧化
B. 从母液中可以提取Na2SO4
C. 反应2中,H2O2做氧化剂
D. 采用减压蒸发可能是为了防止NaClO2受热分解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一混合溶液,只可能含有以下离子中的若干种:K+、![]() 、Cl-、Mg2+、Ba2+、
、Cl-、Mg2+、Ba2+、![]() 、
、![]() ,现取三份100 mL该溶液进行如下实验:
,现取三份100 mL该溶液进行如下实验:
(1)向第一份溶液中加入AgNO3溶液时有沉淀产生;
(2)向第二份溶液中加入足量NaOH溶液并加热后,收集到气体0.06 mol;
(3)向第三份溶液中加入足量BaCl2溶液后,所得沉淀经洗涤、干燥、称量为8.24 g,经足量盐酸洗涤、干燥后,沉淀质量为2.33 g。
根据上述实验,以下推测正确的是( )
A. K+可能存在 B. 100 mL溶液中含0.01 mol ![]()
C. Cl可能存在 D. Ba2+一定不存在,Mg2+可能存在
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应速率和限度与生产、生活密切相关。
(1)某学生为了探究锌与盐酸反应过程中的速率变化,在400mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值):
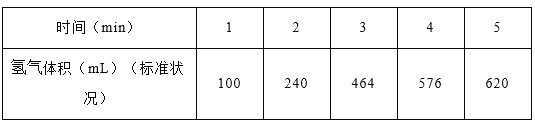
①哪一时间段反应速率最大______min(填0~1、1~2、2~3、3~4、4~5),原因是_____。
②求3~4分钟时间段以盐酸的浓度变化来表示的该反应速率_________(设溶液体积不变)。
(2)另一学生为控制反应速率防止反应过快难以测量氢气体积,他事先在盐酸中加入等体积的下列溶液以减慢反应速率,你认为不可行的是____。
A.蒸馏水 B.KCl溶液 C.KNO3溶液 D.CuSO4溶液
(3)某温度下在4L密闭容器中,X、Y、Z三种气态物质的物质的量随时间变化曲线如图。
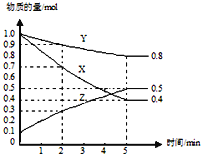
①该反应的化学方程式是_______。
②该反应达到平衡状态的标志是______
A.Y的体积分数在混合气体中保持不变
B.X、Y的反应速率比为3∶1
C.容器内气体压强保持不变
D.容器内气体的总质量保持不变
E.生成1mol Y的同时消耗2mol Z
③2min内Y的转化率为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知H2(g)+2ICl(g)![]() I2(g)+2HCl(g),该反应分①、②两步进行,其能量曲线如图所示,
I2(g)+2HCl(g),该反应分①、②两步进行,其能量曲线如图所示,
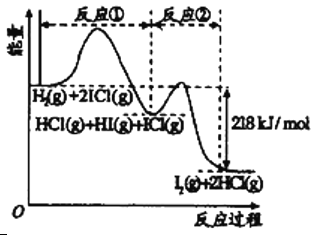
下列有关说法正确的是
A. 反应①为吸热反应
B. 反应①和②均是同种元素间发生的氧化还原反应
C. 反应①比反应②的速率慢,与图中相应峰高有关
D. HI(g)+ICl(g) ![]() I2(g)+HCl(g)生成1摩尔HCl放出218kJ的热量
I2(g)+HCl(g)生成1摩尔HCl放出218kJ的热量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com