
【题目】以氯酸钠(NaClO3)等为原料制备亚氯酸钠(NaClO2)的工艺流程如下,下列说法中,不正确的是
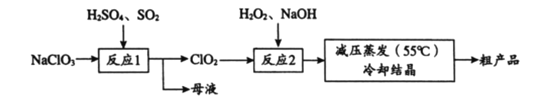
A. 反应1中,每生成1 mol ClO2有0.5 mol SO2被氧化
B. 从母液中可以提取Na2SO4
C. 反应2中,H2O2做氧化剂
D. 采用减压蒸发可能是为了防止NaClO2受热分解
【答案】C
【解析】A. 在反应1中,NaClO3和SO2在硫酸的作用下生成Na2SO4和ClO2,反应的离子方程式为2ClO3-+SO2=SO42-+2ClO2,根据方程式可知,每生成1 mol ClO2有0.5 mol SO2被氧化,故A正确;B. 根据上述分析可知,反应1中除了生成ClO2,还有Na2SO4生成,则从母液中可以提取Na2SO4,故B正确;C. 在反应2中,ClO2与H2O2在NaOH作用下反应生成NaClO2,氯元素的化合价从+4价降低到+3价,则ClO2是氧化剂,H2O2是还原剂,故C错误;D. 减压蒸发在较低温度下能够进行,可以防止常压蒸发时温度过高,NaClO2受热分解,故D正确;答案选C。


 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案科目:高中化学 来源: 题型:
【题目】化合物AX3和单质X2在一定条件下反应可生成化合物AX5。回答下列问题:
(1)已知AX3的熔点和沸点分别为-93.6 ℃和76 ℃,AX5的熔点为167 ℃。室温时AX3与气体X2反应生成1 mol AX5,放出热量123.8 kJ。该反应的热化学方程式为__________________________。
(2)反应AX3(g)+X2(g)![]() AX5(g)在容积为10 L的密闭容器中进行。起始时AX3和X2均为0.2mol。反应在不同条件下进行,反应体系总压强随时间的变化如图所示。
AX5(g)在容积为10 L的密闭容器中进行。起始时AX3和X2均为0.2mol。反应在不同条件下进行,反应体系总压强随时间的变化如图所示。
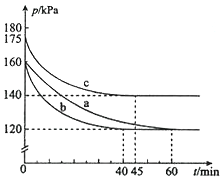
①实验a从反应开始至达到平衡时的反应速率v(AX5)=________(保留两位有效数字)。
②图中3组实验从反应开始至达到平衡时的反应速率v(AX5)由大到小的次序为___________ (填实验序号);与实验a相比,其他两组改变的实验条件及判断依据是:
b____________________、c____________________。
③用p0表示开始时总压强,p表示平衡时总压强,α表示AX3的平衡转化率,则α的表达式为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,用0.1 mol·L-1的HCl溶液逐滴滴入10.00 mL0.1 mol·L-1的NH3·H2O溶液中,其AG值变化的曲线如图所示。已知AG=![]() ,下列分析错误的是
,下列分析错误的是
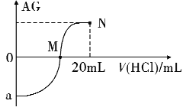
A. 滴定前HC1溶液的AG =12;图中a<0
B. M点为完全反应点,V( HCl) =10 mL,且c(Cl-) >c(NH4+)
C. 从M点到N点水的电离程度先增大后减小
D. N点溶液中:c(Cl-) =2c(NH3·H2O) +2c(NH4+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钙,化学式为CaO2,微溶于水,溶于酸,可用作分析试剂、医用防腐剂、消毒剂。现有一种制备过氧化钙的实验方案,流程如下图,其主要反应的化学方程式为:CaCl2+2NH3·H2O+H2O2=CaO2↓+2NH4Cl+2H2O表示。回答下列问题:
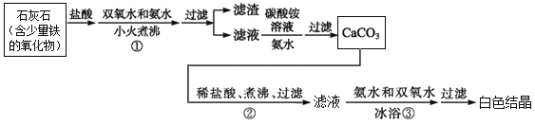
(1)步骤①中,加入氨水的目的是_____________,小火煮沸的作用是________________________。
(2)步骤②的具体操作为逐滴加入稀盐酸,至溶液中尚存有少量固体;再将溶液煮沸,趁热过滤。此过程中,将溶液煮沸的作用是________________________________________。
(3)制备过氧化钙的另一种方法是:将石灰石煅烧后,直接加入双氧水反应,过滤后可得到产品。此法工艺简单、操作方便,但是得到的产品纯度较低,往往CaCO3、Ca(OH)2等杂质含量较高。若实验室只提供稀盐酸和澄清石灰水两瓶试剂,以及试管、小烧杯、胶头滴管、药匙各1个,请设计实验检验所得产品中含有CaCO3。_____________________________(简要描述方案即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物物G是一种用于合成γ-分泌调节剂的药物中间体,其合成路线流程图如下:
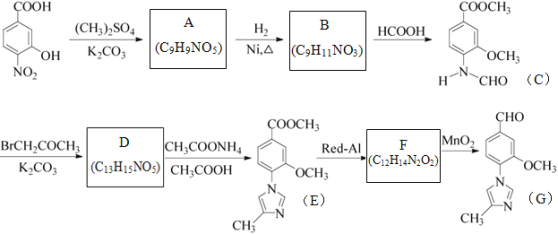
已知:![]()
请回答:
(1)B的结构简式为___________________。
(2)下列说法正确的是__________________。
A.化合物A能与FeCl3溶液发生显色反应
B.1mol化合物C最多能与2molNaOH反应
C.化合物E既有氧化性,又有还原性
D.由流程可知,Red-Al、MnO2分别做还原剂、氧化剂,其中MnO2也可用Cu/O2、足量的酸性高锰酸钾等代替
E.化合物G的最简式为C6H6NO
(3)C→D的过程中有一种无色无味气体产生,其化学方程式为____________________。
(4)写出同时满足下列条件的B的同分异构体的结构简式____________________。
①含有苯环,且分子中有一个手性碳原子;
②能发生水解反应,水解产物之一是α-氨基酸,另一水解产物分子中只有2种不同化学环境的氢。
(5)已知: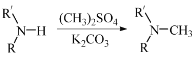 (R代表烃基,R'代表烃基或H)。请写出以
(R代表烃基,R'代表烃基或H)。请写出以![]() 、
、![]() 和(CH3)2SO4为原料制备
和(CH3)2SO4为原料制备![]() 的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干) _________。
的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干) _________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某二元化合物X是锂硫电池的电极材料,为探究其组成进行了如下实验:
固体乙是一种单质,固体丙呈红棕色,将气体A通入溶液C中也能生成固体乙。
请回答:
(1)X的化学式是_________________,步骤①的化学方程式是_________________________。
(2)气体A通入溶液C发生反应的离子方程式是_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质转化在给定条件下不能实现的是
A. Fe2O3![]() FeCl3(aq)
FeCl3(aq)![]() 无水FeCl3
无水FeCl3
B. Al2O3![]() NaAlO2(aq)
NaAlO2(aq)![]() AlCl3
AlCl3
C. Na![]() Na2O
Na2O![]() Na2O2
Na2O2
D. 饱和NaCl(aq)![]() NaHCO3
NaHCO3 ![]() Na2CO3
Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
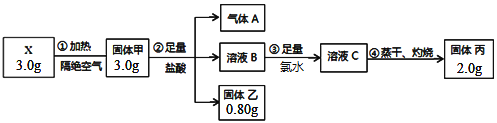
【题目】高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂,其生产工艺如下:
(1)反应①应在温度较低的情况下进行。因在温度较高时KOH与Cl2反应生成的是KClO3。写出在温度较高时KOH与Cl2反应的化学方程式_________________________________,该反应的氧化产物是_______________。
(2)在溶液Ⅰ中加入KOH固体的目的是________________ (填编号)。
A.与溶液Ⅰ中过量的Cl2继续反应,生成更多的KClO
B.KOH固体溶解时会放出较多的热量,有利于提高反应速率
C.为下一步反应提供碱性的环境
D.使KClO3转化为KClO
(3)从溶液Ⅱ中分离出K2FeO4后,还会有副产品KNO3、KCl,则反应③中发生的离子反应方程式为_______________________________________________。
(4)如何判断K2FeO4晶体已经洗涤干净______________________________。
(5)高铁酸钾(K2FeO4)作为水处理剂的一个优点是能与水反应生成胶体吸附杂质,配平该反应的离子方程式:________
___FeO42-+____H2O — ____Fe(OH)3(胶体)+____O2↑+____OH-。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】上世纪末,科学家研制得到一种新的分子,它具有空心的、类似足球的结构![]() 如图
如图![]() ,化学式为
,化学式为![]() ,下列说法中正确的是
,下列说法中正确的是![]()
![]()
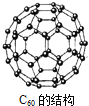
A. ![]() 是一种新型的化合物
是一种新型的化合物
B. ![]() 中含有离子键
中含有离子键
C. ![]() 和金刚石、石墨都是碳元素的不同单质
和金刚石、石墨都是碳元素的不同单质
D. ![]() 的摩尔质量为720
的摩尔质量为720
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com