
【题目】上世纪末,科学家研制得到一种新的分子,它具有空心的、类似足球的结构![]() 如图
如图![]() ,化学式为
,化学式为![]() ,下列说法中正确的是
,下列说法中正确的是![]()
![]()
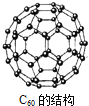
A. ![]() 是一种新型的化合物
是一种新型的化合物
B. ![]() 中含有离子键
中含有离子键
C. ![]() 和金刚石、石墨都是碳元素的不同单质
和金刚石、石墨都是碳元素的不同单质
D. ![]() 的摩尔质量为720
的摩尔质量为720
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案科目:高中化学 来源: 题型:
【题目】以氯酸钠(NaClO3)等为原料制备亚氯酸钠(NaClO2)的工艺流程如下,下列说法中,不正确的是
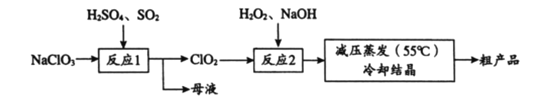
A. 反应1中,每生成1 mol ClO2有0.5 mol SO2被氧化
B. 从母液中可以提取Na2SO4
C. 反应2中,H2O2做氧化剂
D. 采用减压蒸发可能是为了防止NaClO2受热分解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氟化氮(NF3)是一种无色、无味的气体,它是微电子工业技术的关键原料之一。
(l)三氟化氮可由氨气和氟气反应得到: 4NH3+3F2=NF3+3NH4F。NH3的电子式为__________,反应中氨气显示的化学性质有______________,当有17.0 g氨气发生反应时,转移电子的物质的量为_____。
(2)在潮湿的空气中,NF3能与水蒸气发生反应,产物有HF、NO和一种酸,则被氧化与被还原元素原子的物质的量之比为_________,NF3、F2、NO三种气体氧化性由弱到强的顺序为_________。
(3)三氟化氮在空气中泄露时,很易被发现,依据的现象是______________________。
(4)NCl3结构类似NF3,但NCl3中N元素显-3价,NCl3遇水发生反应,目反应为非氧化还原反应,该反应的化学方程式为____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化铝(AlN)是一种新型无机非金属材料,某AlN样品仅含有Al2O3杂质,为测定AlN的含量,设计如下三种实验方案。已知:AlN+NaOH+H2O=NaAlO2+NH3↑
(方案1)取一定量的样品,用以下装置测定样品中AlN的纯度(夹持装置已略去)。
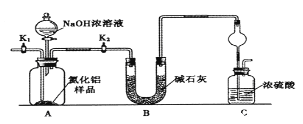
(1)如图C装置中球形干燥管的作用是______________。
(2)完成以下实验步骤:组装好实验装置,首先______;再加入实验药品。接下来的实验操作是____,打开分液漏斗活塞,加入NaOH浓溶液,至不再产生气体。打开K1,通入氮气一段时间,测定C装置反应前后的质量变化。通入氮气的目的是______________。
(3)由于装置存在缺陷,导致测定结果偏高,请提出改进意见_________。
(方案2)用如下图装置测定m g样品中A1N的纯度(部分夹持装置已略去)。
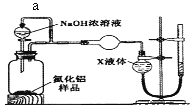
(4)导管a的主要作用是______________。
(5)为测定生成气体的体积,量气装置中的X液体可以是____________。(填选项序号)
a.CCl4 b.H2O c.NH4Cl溶液 d.![]()
(6)若mg样品完全反应,测得生成气体的体积为VmL,(已转换为标准状况),则A1N的质量分数为___(用含V、m的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知H2(g)+2ICl(g)![]() I2(g)+2HCl(g),该反应分①、②两步进行,其能量曲线如图所示,
I2(g)+2HCl(g),该反应分①、②两步进行,其能量曲线如图所示,
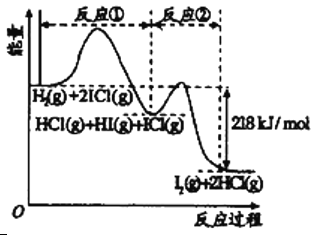
下列有关说法正确的是
A. 反应①为吸热反应
B. 反应①和②均是同种元素间发生的氧化还原反应
C. 反应①比反应②的速率慢,与图中相应峰高有关
D. HI(g)+ICl(g) ![]() I2(g)+HCl(g)生成1摩尔HCl放出218kJ的热量
I2(g)+HCl(g)生成1摩尔HCl放出218kJ的热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,草酸溶液中部分微粒的物质的量浓度随NaOH溶液的加入pH 的变化如图所示。其中c (H2C2O4) +c (HC2O4-)+ c (C2O42-)=0.1mol/L,下列说法不正确的是

A. H2C2O4的Ka2数量级为10-5
B. NaHC2O4溶液中,c (Na+)>c(HC2O4-)>c (H+)>c (OH-)
C. 0.1mol/L 的H2C2O4溶液,H2C2O4的电离度为80%
D. pH=7.0的溶液中,c (Na+)=0.1 + c(C2O42-) - c (H2C2O4)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁被誉为“第一金属”,铁及其化合物在生活中有广泛应用。
![]() 的熔点为
的熔点为![]() ,沸点为
,沸点为![]() 的晶体类型是 ______ ;
的晶体类型是 ______ ;
![]() 羰基铁
羰基铁![]() 可用作催化剂、汽油抗爆剂等。1mol
可用作催化剂、汽油抗爆剂等。1mol![]() 分子中含______
分子中含______![]() 键;
键;
![]() 氮化铁晶体的晶胞结构如图1所示。该晶体中铁、氮的微粒个数之比为 ______ ;
氮化铁晶体的晶胞结构如图1所示。该晶体中铁、氮的微粒个数之比为 ______ ;
![]() 氧化亚铁晶体的晶胞如图2所示。已知:
氧化亚铁晶体的晶胞如图2所示。已知:
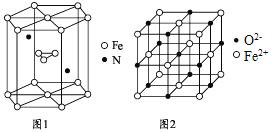
氧化亚铁晶体的密度为![]() ,
,![]() 代表阿伏加德罗常数的值。在该晶胞中,与
代表阿伏加德罗常数的值。在该晶胞中,与![]() 紧邻且等距离的
紧邻且等距离的![]() 数目为 ______ ;
数目为 ______ ;![]() 与
与![]() 最短核间距为 ______ pm。
最短核间距为 ______ pm。![]() 写出表达式
写出表达式![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的数值,下列说法错误的是
A. 7gCnH2n中含有NA个碳氢共价键
B. 标准状况下,22.4LCHCl3中含有3NA个氯原子
C. 含0.3molNH4NO3与amolNH3·H2O的中性溶液中含0.3NA个NH4+
D. 1molNa与O2反应生成Na2O和Na2O2的混合物的过程中失去NA个电子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com