
【题目】铁被誉为“第一金属”,铁及其化合物在生活中有广泛应用。
![]() 的熔点为
的熔点为![]() ,沸点为
,沸点为![]() 的晶体类型是 ______ ;
的晶体类型是 ______ ;
![]() 羰基铁
羰基铁![]() 可用作催化剂、汽油抗爆剂等。1mol
可用作催化剂、汽油抗爆剂等。1mol![]() 分子中含______
分子中含______![]() 键;
键;
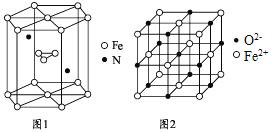
![]() 氮化铁晶体的晶胞结构如图1所示。该晶体中铁、氮的微粒个数之比为 ______ ;
氮化铁晶体的晶胞结构如图1所示。该晶体中铁、氮的微粒个数之比为 ______ ;
![]() 氧化亚铁晶体的晶胞如图2所示。已知:
氧化亚铁晶体的晶胞如图2所示。已知:
氧化亚铁晶体的密度为![]() ,
,![]() 代表阿伏加德罗常数的值。在该晶胞中,与
代表阿伏加德罗常数的值。在该晶胞中,与![]() 紧邻且等距离的
紧邻且等距离的![]() 数目为 ______ ;
数目为 ______ ;![]() 与
与![]() 最短核间距为 ______ pm。
最短核间距为 ______ pm。![]() 写出表达式
写出表达式![]()
【答案】 分子晶体 10 3:1 12 ![]() 1010
1010
【解析】(1)FeCl3的熔沸点较低,FeCl3的晶体类型是分子晶体。
(2)CO的结构式为C![]() O,三键中含1个σ键和2个π键,中心原子Fe与配体CO之间形成配位键,配位键也是σ键。
O,三键中含1个σ键和2个π键,中心原子Fe与配体CO之间形成配位键,配位键也是σ键。
(3)用“均摊法”确定晶胞中铁、氮的个数。
(4)根据晶胞,Fe2+为面心立方,与Fe2+紧邻的等距离的Fe2+有12个。由晶体的密度计算1mol晶体的体积,结合晶胞中所含微粒数计算晶胞的体积,用立体几何知识计算晶胞边长和Fe2+与O2-的最短核间距。
(1)FeCl3的熔沸点较低,FeCl3的晶体类型是分子晶体。
(2)CO的结构式为C![]() O,三键中含1个σ键和2个π键,中心原子Fe与配体CO之间形成配位键,配位键也是σ键;1个Fe(CO)5分子中含10个σ键,1molFe(CO)5分子中含10molσ键。
O,三键中含1个σ键和2个π键,中心原子Fe与配体CO之间形成配位键,配位键也是σ键;1个Fe(CO)5分子中含10个σ键,1molFe(CO)5分子中含10molσ键。
(3)用“均摊法”,晶胞中含Fe:12![]() +2
+2![]() +3=6个,N:2个,该晶体中铁、氮的微粒个数之比为6:2=3:1。
+3=6个,N:2个,该晶体中铁、氮的微粒个数之比为6:2=3:1。
(4)根据晶胞,Fe2+为面心立方,与Fe2+紧邻的等距离的Fe2+有12个。用“均摊法”,晶胞中含Fe2+:8![]() +6
+6![]() =4个,含O2-:12
=4个,含O2-:12![]() +1=4个,晶体的化学式为FeO;1molFeO的质量为72g,1mol晶体的体积为
+1=4个,晶体的化学式为FeO;1molFeO的质量为72g,1mol晶体的体积为![]() cm3;晶胞的体积为
cm3;晶胞的体积为![]() cm3
cm3![]() NA
NA![]() 4=
4=![]() cm3,晶胞的边长为
cm3,晶胞的边长为![]() cm,Fe2+与O2-最短核间距为
cm,Fe2+与O2-最短核间距为![]() cm=
cm=![]() cm=
cm=![]() 1010pm。
1010pm。


 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案科目:高中化学 来源: 题型:
【题目】高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂,其生产工艺如下:
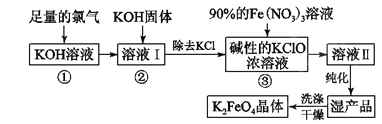
(1)反应①应在温度较低的情况下进行。因在温度较高时KOH与Cl2反应生成的是KClO3。写出在温度较高时KOH与Cl2反应的化学方程式_________________________________,该反应的氧化产物是_______________。
(2)在溶液Ⅰ中加入KOH固体的目的是________________ (填编号)。
A.与溶液Ⅰ中过量的Cl2继续反应,生成更多的KClO
B.KOH固体溶解时会放出较多的热量,有利于提高反应速率
C.为下一步反应提供碱性的环境
D.使KClO3转化为KClO
(3)从溶液Ⅱ中分离出K2FeO4后,还会有副产品KNO3、KCl,则反应③中发生的离子反应方程式为_______________________________________________。
(4)如何判断K2FeO4晶体已经洗涤干净______________________________。
(5)高铁酸钾(K2FeO4)作为水处理剂的一个优点是能与水反应生成胶体吸附杂质,配平该反应的离子方程式:________
___FeO42-+____H2O — ____Fe(OH)3(胶体)+____O2↑+____OH-。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】上世纪末,科学家研制得到一种新的分子,它具有空心的、类似足球的结构![]() 如图
如图![]() ,化学式为
,化学式为![]() ,下列说法中正确的是
,下列说法中正确的是![]()
![]()
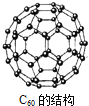
A. ![]() 是一种新型的化合物
是一种新型的化合物
B. ![]() 中含有离子键
中含有离子键
C. ![]() 和金刚石、石墨都是碳元素的不同单质
和金刚石、石墨都是碳元素的不同单质
D. ![]() 的摩尔质量为720
的摩尔质量为720
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了减少城市空气污染,要求使用无铅汽油,所谓无铅汽油是指( )
A.不用铅桶装的汽油
B.不含四乙基铅的汽油
C.不含Pb(NO3)2的汽油
D.不含氧化铅的汽油
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列变化属于氮的固定的是
A. 工业上用氨气和硝酸合成硝酸铵
B. 氯化铵受热分解生成氨气和氯化氢
C. 氨气与氯气反应生成氮气
D. 氮气和氧气在放电条件下生成NO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】密度为0.91g/cm3的氨水,质量分数为25%,该氨水用等体积的水稀释后,所得溶液溶质质量分数为
A. 12.5%B. >12.5%C. <12.5%D. 无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,正确的是
A.通过石油分馏可以获得大量的芳香烃
B.石油裂化的目的是为了得到乙烯、丙烯和苯
C.煤的干馏发生了化学变化
D.煤中含有苯和甲苯,可以通过先干馏后分馏的方法得到苯和甲苯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】血红蛋白中含有Fe2+离子,误食亚硝酸盐,Fe2+离子将转变成Fe3+离子,使血红蛋白失去与O2结合的能力。服用维生素C可缓解,说明维生素C具有
A.酸性B.碱性C.氧化性D.还原性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】全钒液流储能电池一次性充电后,续航能力可达1000km,而充电时间只需3~5min,被誉为“完美电池”,其原理如图所示(已知V2+呈紫色,V3+呈绿色)。电池放电时,左槽溶液质量增加。下列说法正确的是

A. 充电时的阴极反应为VO2++2H++e-=VO2++H2O
B. 放电时的正极反应为V3++e-=V2+
C. 放电过程中,右槽溶液由紫色变为绿色
D. 若负载为用石墨电极电解食盐水的装置,生成4gNaOH时该电池中消耗0.1molH+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com