
【题目】密度为0.91g/cm3的氨水,质量分数为25%,该氨水用等体积的水稀释后,所得溶液溶质质量分数为
A. 12.5%B. >12.5%C. <12.5%D. 无法确定
科目:高中化学 来源: 题型:
【题目】铬合金有重要的用途,从其废料中制取铬的流程如下:
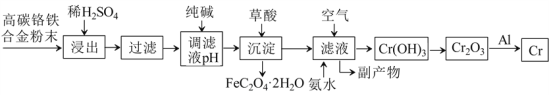
已知: ① Cr+H2SO4=CrSO4+H2↑,
② 流程中铬元素浸出之后至生成Cr(OH)3之间均以自由移动离子状态存在于溶液中。
请回答下列问题:
(1)稀硫酸酸浸过程中,提高“浸出率”的措施有:________________________ (写一条即可) 。
(2)用纯碱调节滤液pH,得到某弱碱沉淀,若纯碱过量,则可能导致的后果是_:_____________。
(3)流程中的“副产物”中,可用作可溶性钡盐中毒解毒剂的物质的化学式是___________;可用作化肥的物质的化学式是_____________。
(4)加入草酸实现沉淀转化反应化学方程式为:_______________________________________。
(5)流程中利用铝热反应冶炼铬的化学方程式为:_____________________________________。
(6)流程中由滤液生成Cr(OH)3的化学方程式为:_____________________________________。
(7)除已知反应①之外,整个流程中涉及的主要氧化还原反应有_____个,分解反应有____个。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁被誉为“第一金属”,铁及其化合物在生活中有广泛应用。
![]() 的熔点为
的熔点为![]() ,沸点为
,沸点为![]() 的晶体类型是 ______ ;
的晶体类型是 ______ ;
![]() 羰基铁
羰基铁![]() 可用作催化剂、汽油抗爆剂等。1mol
可用作催化剂、汽油抗爆剂等。1mol![]() 分子中含______
分子中含______![]() 键;
键;
![]() 氮化铁晶体的晶胞结构如图1所示。该晶体中铁、氮的微粒个数之比为 ______ ;
氮化铁晶体的晶胞结构如图1所示。该晶体中铁、氮的微粒个数之比为 ______ ;
![]() 氧化亚铁晶体的晶胞如图2所示。已知:
氧化亚铁晶体的晶胞如图2所示。已知:
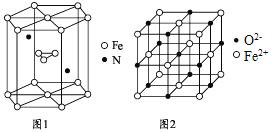
氧化亚铁晶体的密度为![]() ,
,![]() 代表阿伏加德罗常数的值。在该晶胞中,与
代表阿伏加德罗常数的值。在该晶胞中,与![]() 紧邻且等距离的
紧邻且等距离的![]() 数目为 ______ ;
数目为 ______ ;![]() 与
与![]() 最短核间距为 ______ pm。
最短核间距为 ______ pm。![]() 写出表达式
写出表达式![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】普鲁卡因毒性较小,是临床常用的局部麻药之一。某兴趣小组以苯和乙烯为主要原料,采用以下路线
合成:
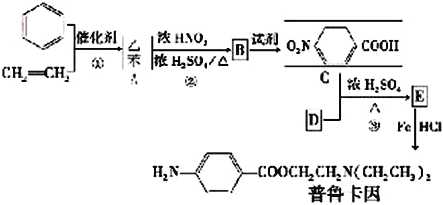
请回答下列问题:
(1)写出下列反应类型,反应①属于_________反应,反应②属于__________反应。反应②中混酸的配制方法为________________________________________。化合物B的结构简式___________________。
(2)写出C中所含的1个官能团的名称是:__________________________。已知: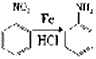 (NH3分子去掉一个H原子叫氨基-NH2)。并写出C+D-→E 反应的化学方程式:_______________________________。
(NH3分子去掉一个H原子叫氨基-NH2)。并写出C+D-→E 反应的化学方程式:_______________________________。
(3)已知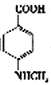 与化合物B 是同分异构体,且同时符合下列条件①②。写出同时符合下列条件的B的2个同分异构体的结构简式_________________、_____________________。
与化合物B 是同分异构体,且同时符合下列条件①②。写出同时符合下列条件的B的2个同分异构体的结构简式_________________、_____________________。
①分子中含有羧基 ②分子中含有苯环,且含有两个处于对位的取代基
(4)a-甲基苯乙烯(AMS) ![]() 与乙苯都属于烃类中的同一类别,该类别的名称是________。
与乙苯都属于烃类中的同一类别,该类别的名称是________。
a.芳香烃 b.烯烃 c.苯的同系物
(5)设计一条由AMS合成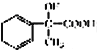 的合成路线:___________________________________。
的合成路线:___________________________________。
(合成路线常用的表示方式为:![]() )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A. 200 mL 2 mol·L-1的FeBr2溶液中通入11.2 L标准状况下的氯气:4Fe2++6Br-+5Cl2===4Fe3++3Br2+10Cl-
B. 以石墨作电极电解氯化铝溶液:2Cl-+2H2O![]() 2OH-+H2↑+Cl2↑
2OH-+H2↑+Cl2↑
C. 氢氧化钠溶液吸收足量SO2气体:SO2+2OH-===SO![]() +H2O
+H2O
D. 向明矾溶液中加入氢氧化钡溶液至沉淀的物质的量最大:Al3++2SO![]() +2Ba2++4OH-===2BaSO4↓+AlO
+2Ba2++4OH-===2BaSO4↓+AlO![]() +2H2O
+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用甲烷与氯气发生取代反应制取副产品盐酸的设想在工业上已成为现实。某化学兴趣小组在实验室中模拟上述过程,其设计的模拟装置如下:
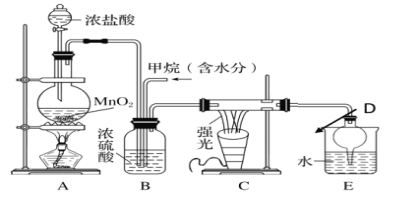
试回答下列问题:
(1)请写出C装置中生成CH2Cl2的化学方程式:_________________________________。有人认为E中有氯化氢产生,不能证明甲烷与氯气发生了取代反应,你认为他的看法___________(填“正确”或“不正确”)。
(2)B装置有三种功能:①混匀混合气体;②控制气流速率; ③___________。
(3)D装置的名称为___________,其作用是___________。
(4)E装置中除盐酸外,还含有机物,从E中分离出盐酸的最佳方法为___________(填字母)。
a.分液法 b.蒸馏法 c.结晶法
(5)将1mol CH4与Cl2发生取代反应,充分反应后生成的CH3Cl、CH2Cl2、CHCl3、CCl4四种有机产物的物质的量依次增大0.1mol,则参加反应的Cl2的物质的量为____,生成HCl的总物质的量为___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com