
【题目】普鲁卡因毒性较小,是临床常用的局部麻药之一。某兴趣小组以苯和乙烯为主要原料,采用以下路线
合成:
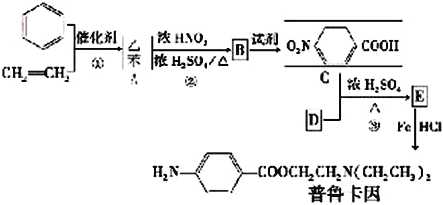
请回答下列问题:
(1)写出下列反应类型,反应①属于_________反应,反应②属于__________反应。反应②中混酸的配制方法为________________________________________。化合物B的结构简式___________________。
(2)写出C中所含的1个官能团的名称是:__________________________。已知: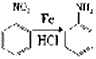 (NH3分子去掉一个H原子叫氨基-NH2)。并写出C+D-→E 反应的化学方程式:_______________________________。
(NH3分子去掉一个H原子叫氨基-NH2)。并写出C+D-→E 反应的化学方程式:_______________________________。
(3)已知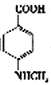 与化合物B 是同分异构体,且同时符合下列条件①②。写出同时符合下列条件的B的2个同分异构体的结构简式_________________、_____________________。
与化合物B 是同分异构体,且同时符合下列条件①②。写出同时符合下列条件的B的2个同分异构体的结构简式_________________、_____________________。
①分子中含有羧基 ②分子中含有苯环,且含有两个处于对位的取代基
(4)a-甲基苯乙烯(AMS) ![]() 与乙苯都属于烃类中的同一类别,该类别的名称是________。
与乙苯都属于烃类中的同一类别,该类别的名称是________。
a.芳香烃 b.烯烃 c.苯的同系物
(5)设计一条由AMS合成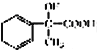 的合成路线:___________________________________。
的合成路线:___________________________________。
(合成路线常用的表示方式为:![]() )
)
【答案】加成 取代 把浓硫酸慢慢注入浓硝酸中,边加边搅拌(振荡) ![]() 苯环、羧基、硝基任选一
苯环、羧基、硝基任选一 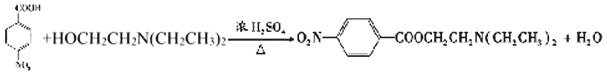
 、
、 任写两种皆可 a
任写两种皆可 a 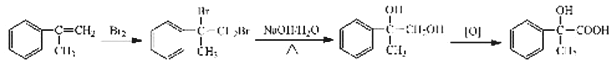
【解析】
试题由流程可知,苯和乙烯发生加成反应生成乙苯,乙苯与混酸发生硝化反应生成B,B经氧化生成C,由C的结构可知B为对硝基苯乙苯, C与D发生酯化反应生成E,E发生还原反应生成普鲁卡因,由普鲁卡因的结构可推断D为HOCH2CH2N(CH2CH3)2。
(1)反应①属于加成反应,反应②属于取代反应。反应②中混酸的配制方法可以类比浓硫酸的稀释,个体操作是:把浓硫酸慢慢注入浓硝酸中,边加边搅拌(或振荡)。化合物B的结构简式为![]() 。
。
(2)C为对硝基苯甲酸,其中所含的官能团有羧基、硝基等。由题中信息可知,C+D-→E 反应为酯化反应,该反应的化学方程式为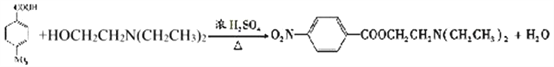 。
。
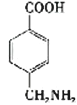
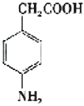
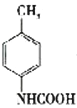
(3)已知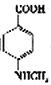 与化合物B 是同分异构体,且同时符合下列条件:①分子中含有羧基;②分子中含有苯环,且含有两个处于对位的取代基。同时符合这两个条件的B可能是
与化合物B 是同分异构体,且同时符合下列条件:①分子中含有羧基;②分子中含有苯环,且含有两个处于对位的取代基。同时符合这两个条件的B可能是 、
、 或
或 。
。
(4)a-甲基苯乙烯(AMS) ![]() 与乙苯分子中都含有苯环,所以它们都属于芳香烃,选a。
与乙苯分子中都含有苯环,所以它们都属于芳香烃,选a。
(5)由AMS(![]() )合成
)合成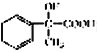 ,可以先由AMS与溴发生加成反应生成1,2-二溴-2-苯基丙烷,然后1,2-二溴-2-苯基丙烷发生水解反应生成2-苯基-1,2-丙二醇,最后2-苯基-1,2-丙二醇经催化氧化得到产品。具体合成路线如下:
,可以先由AMS与溴发生加成反应生成1,2-二溴-2-苯基丙烷,然后1,2-二溴-2-苯基丙烷发生水解反应生成2-苯基-1,2-丙二醇,最后2-苯基-1,2-丙二醇经催化氧化得到产品。具体合成路线如下: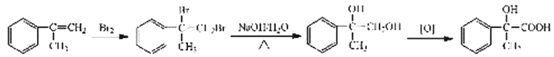 。
。


科目:高中化学 来源: 题型:
【题目】下列关于化学式为![]() 的配合物的说法中正确的是
的配合物的说法中正确的是![]()
![]()
A. 配体是![]() 和
和![]() ,配位数是9
,配位数是9
B. 中心离子是![]() ,配离子是
,配离子是![]()
C. 内界和外界中的![]() 的数目比是2:1
的数目比是2:1
D. 加入足量![]() 溶液,所有
溶液,所有![]() 均被完全沉淀
均被完全沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用阴离子交换膜控制电解液中OH-的浓度制备纳米Cu2O,反应为2Cu+H2O![]() Cu2O+H2↑,装置如图,下列说法中正确的是
Cu2O+H2↑,装置如图,下列说法中正确的是
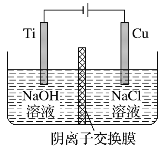
A. 电解时Cl-通过交换膜向Ti极移动
B. 阳极发生的反应为:2Cu -2e- +2OH- = Cu2O+H2O
C. 阴极OH-放电,有O2生成
D. Ti电极和Cu电极生成物物质的量之比为2∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对羟基苯乙酸是合成药物的中间体,其制备路线如下(A为芳香烃):
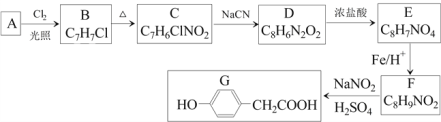
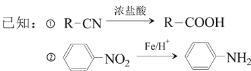
回答下列问题:
(1)A的名称是______________。
(2)B→C的反应试剂是_______ ,反应类型是_______;E→F的反应类型是_______。
(3)C→D反应的化学方程式为________________。
(4)E中含氧官能团的名称为______。
(5)1molG与足量NaOH溶液反应,可以消耗_____molNaOH。
(6)H是G的同系物,满足下列条件的H的同分异构体有_______种(不考虑立体异构)。
① H相对分子质量比G大14 ② 苯环上含两个取代基
其中核磁共振氢谱为六组峰,峰面积之比为1:2:2:2:2:1的结构简式为_____________。
(7)结合以上合成路线及相关信息,设计由苯制备苯酚的合成路线________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】密度为0.91g/cm3的氨水,质量分数为25%,该氨水用等体积的水稀释后,所得溶液溶质质量分数为
A. 12.5%B. >12.5%C. <12.5%D. 无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ、实验室常用MnO2与浓盐酸反应制备Cl2(MnO2+4HCl(浓)→MnCl2+Cl2↑+2H2O反应装置如图所示)。
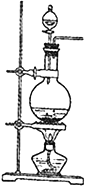
(1)装置图中的主要玻璃仪器有酒精灯、________、__________等。产生的氯气通入水中制得氯水备用。氯水含有的离子除H+、Cl-外还有___________等离子,氯水中因含有__________而具有漂白性。
Ⅱ、某氯化铁样品含有少量FeCl2杂质。现要测定其中铁元素的质量分数,实验按以下步骤进行:
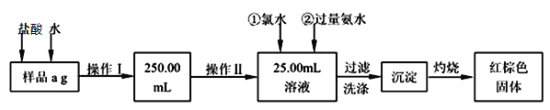
请根据上面流程,回答以下问题:
(2)样品溶解时加盐酸的作用是___________________________________。加入氯水所发生反应的离子方程式___________________________________。
(3)证明Fe3+离子已经沉淀完全的操作是___________________________________。将沉淀物加热灼烧过程中,为使实验结果准确,必须的操作为___________________。
(4)若原样品质量a 为40.00g,加热后红棕色固体质量b为2.200g,则样品中铁元素的质量分数是_________;若称量准确,最终测量的结果偏大,则造成误差的原因可能是_____________(写出一种原因即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛冶炼厂与氯碱厂、甲醇厂组成一个产业链(如图所示),将大大提高资源的利用率,减少环境污染。

请回答下列问题:
(1)Fe位于元素周期表中的位置是__________。
(2)写出流程中电解池里发生反应的离子方程式: __________。
(3)写出流程中“氯化”的化学方程式: __________。
(4)写出TiCl4完全水解生成TiO2·H2O的化学方程式: __________。
(5)高温炉中通入Ar的作用是___________。
(6)上述流程中可循环利用的物质有__________。
(7)下图为氯碱工业的装置示意图,使用______(填“阴”或“阳”)离子交换膜,目的除了降低分离氢氧化钠的成本外还可以________。
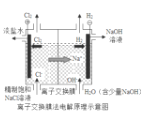
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组探究SO2气体的还原性,装置如图所示,下列说法不合理的是
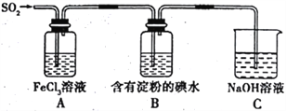
A. A装置中FeCl3溶液逐渐变为浅绿色,可以说明SO2有还原性
B. B装置中蓝色退去,说明还原性:SO2>I-
C. C装置中吸收尾气有可能倒吸
D. A、B装置中发生的反应转移电子数一定相等。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.周期表中金属与非金属分界线左边都为金属元素
B.钠、镁、铝单质的还原性依次减弱
C.氟、氯、溴的非金属性依次增强
D.氢氧化钠、氢氧化钾、氢氧化镁碱性依次减弱
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com