
【题目】全钒液流储能电池一次性充电后,续航能力可达1000km,而充电时间只需3~5min,被誉为“完美电池”,其原理如图所示(已知V2+呈紫色,V3+呈绿色)。电池放电时,左槽溶液质量增加。下列说法正确的是

A. 充电时的阴极反应为VO2++2H++e-=VO2++H2O
B. 放电时的正极反应为V3++e-=V2+
C. 放电过程中,右槽溶液由紫色变为绿色
D. 若负载为用石墨电极电解食盐水的装置,生成4gNaOH时该电池中消耗0.1molH+
 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案 小题狂做系列答案
小题狂做系列答案科目:高中化学 来源: 题型:
【题目】铁被誉为“第一金属”,铁及其化合物在生活中有广泛应用。
![]() 的熔点为
的熔点为![]() ,沸点为
,沸点为![]() 的晶体类型是 ______ ;
的晶体类型是 ______ ;
![]() 羰基铁
羰基铁![]() 可用作催化剂、汽油抗爆剂等。1mol
可用作催化剂、汽油抗爆剂等。1mol![]() 分子中含______
分子中含______![]() 键;
键;
![]() 氮化铁晶体的晶胞结构如图1所示。该晶体中铁、氮的微粒个数之比为 ______ ;
氮化铁晶体的晶胞结构如图1所示。该晶体中铁、氮的微粒个数之比为 ______ ;
![]() 氧化亚铁晶体的晶胞如图2所示。已知:
氧化亚铁晶体的晶胞如图2所示。已知:
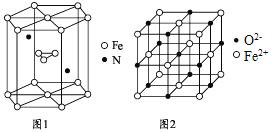
氧化亚铁晶体的密度为![]() ,
,![]() 代表阿伏加德罗常数的值。在该晶胞中,与
代表阿伏加德罗常数的值。在该晶胞中,与![]() 紧邻且等距离的
紧邻且等距离的![]() 数目为 ______ ;
数目为 ______ ;![]() 与
与![]() 最短核间距为 ______ pm。
最短核间距为 ______ pm。![]() 写出表达式
写出表达式![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的数值,下列说法错误的是
A. 7gCnH2n中含有NA个碳氢共价键
B. 标准状况下,22.4LCHCl3中含有3NA个氯原子
C. 含0.3molNH4NO3与amolNH3·H2O的中性溶液中含0.3NA个NH4+
D. 1molNa与O2反应生成Na2O和Na2O2的混合物的过程中失去NA个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今有一混合物的水溶液,只可能含有以下离子中的若干种:K+、NH![]() 、Cl-、Mg2+、Ba2+、CO
、Cl-、Mg2+、Ba2+、CO![]() 、SO
、SO![]() ,现取三份100 mL溶液进行如下实验:
,现取三份100 mL溶液进行如下实验:
(1)第一份加入AgNO3溶液有沉淀产生。
(2)第二份加足量NaOH溶液加热后,收集到气体0.04 mol。
(3)第三份加足量BaCl2溶液后,得干燥沉淀6.27 g,经足量盐酸洗涤、干燥后,沉淀质量为2.33 g。根据上述实验,以下推测正确的是( )
A. Cl-一定不存在
B. 100 mL溶液中含0.01 mol CO![]()
C. K+一定存在
D. Ba2+一定不存在,Mg2+可能存在
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于氨的叙述中,错误的是( )
A.氨易液化,因此可用作制冷剂
B.氨易溶解于水,因此可用来做喷泉实验
C.氨极易溶解于水,因此氨水比较稳定(很难分解)
D.氨溶解于水显弱碱性,因此可使酚酞试剂变为红色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用甲烷与氯气发生取代反应制取副产品盐酸的设想在工业上已成为现实。某化学兴趣小组在实验室中模拟上述过程,其设计的模拟装置如下:
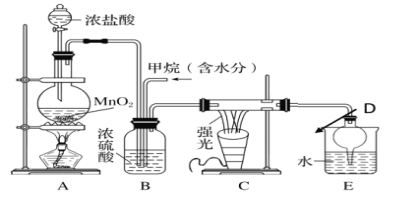
试回答下列问题:
(1)请写出C装置中生成CH2Cl2的化学方程式:_________________________________。有人认为E中有氯化氢产生,不能证明甲烷与氯气发生了取代反应,你认为他的看法___________(填“正确”或“不正确”)。
(2)B装置有三种功能:①混匀混合气体;②控制气流速率; ③___________。
(3)D装置的名称为___________,其作用是___________。
(4)E装置中除盐酸外,还含有机物,从E中分离出盐酸的最佳方法为___________(填字母)。
a.分液法 b.蒸馏法 c.结晶法
(5)将1mol CH4与Cl2发生取代反应,充分反应后生成的CH3Cl、CH2Cl2、CHCl3、CCl4四种有机产物的物质的量依次增大0.1mol,则参加反应的Cl2的物质的量为____,生成HCl的总物质的量为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对羟基苯乙酸是合成药物的中间体,其制备路线如下(A为芳香烃):
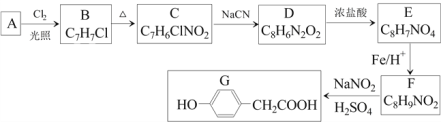
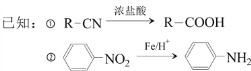
回答下列问题:
(1)A的名称是______________。
(2)B→C的反应试剂是_______ ,反应类型是_______;E→F的反应类型是_______。
(3)C→D反应的化学方程式为________________。
(4)E中含氧官能团的名称为______。
(5)1molG与足量NaOH溶液反应,可以消耗_____molNaOH。
(6)H是G的同系物,满足下列条件的H的同分异构体有_______种(不考虑立体异构)。
① H相对分子质量比G大14 ② 苯环上含两个取代基
其中核磁共振氢谱为六组峰,峰面积之比为1:2:2:2:2:1的结构简式为_____________。
(7)结合以上合成路线及相关信息,设计由苯制备苯酚的合成路线________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将盛有NH4HCO3粉末的小烧杯放入盛有少量醋酸的大烧杯中。然后向小烧杯中加入盐酸,反应剧烈,醋酸逐渐凝固。由此可知( )
A. NH4HCO3和盐酸的反应是放热反应
B. 该反应中,热能转化为产物内部的能量
C. 反应物的总能量高于生成物的总能量
D. 反应物中化学键断裂吸收的能量少
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素W、X、Y、Z的原子序数依次增大,A、B、C、D、E均由上述元素组成的中学化学常见的物质,其中A是单质,C是酸性氧化物,A的水溶液和C均具有漂白性,B是自然界最常见的液体,E是三元化合物,物质之间存在如右下图所示的关系。下列说法不正确的是
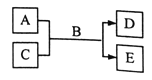
A. 离子半径大小关系:Y>Z>X>W
B. YX2遇到蓝色石蕊试液先变红后褪色
C. 简单阴离子的还原性:Y>Z
D. Y与Z属于同一周期,与X属于同一主族
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com