
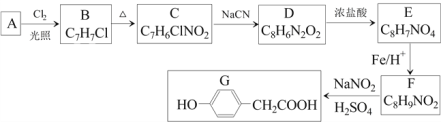
【题目】对羟基苯乙酸是合成药物的中间体,其制备路线如下(A为芳香烃):
回答下列问题:
(1)A的名称是______________。
(2)B→C的反应试剂是_______ ,反应类型是_______;E→F的反应类型是_______。
(3)C→D反应的化学方程式为________________。
(4)E中含氧官能团的名称为______。
(5)1molG与足量NaOH溶液反应,可以消耗_____molNaOH。
(6)H是G的同系物,满足下列条件的H的同分异构体有_______种(不考虑立体异构)。
① H相对分子质量比G大14 ② 苯环上含两个取代基
其中核磁共振氢谱为六组峰,峰面积之比为1:2:2:2:2:1的结构简式为_____________。
(7)结合以上合成路线及相关信息,设计由苯制备苯酚的合成路线________________。
【答案】甲苯 浓硫酸、浓硝酸(或浓H2SO4、浓HNO3,全对才给分)取代反应(或硝化反应)还原反应![]() 羧基、硝基26
羧基、硝基26![]()
![]()
【解析】
A为芳香烃,A与Cl2光照下发生侧链上的取代反应生成B,B的分子式为C7H7Cl,则A为甲苯,A的结构简式为![]() ,B的结构简式为
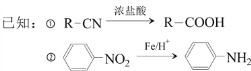
,B的结构简式为![]() ;对比B和C的分子式,B生成C为硝化反应;对比C、D的分子式,C转化为D为C中—Cl被—CN取代;D转化为E发生题给已知①的反应,D中—CN水解成—COOH;E转化为F发生题给已知②的反应,E中—NO2被还原成—NH2;F与NaNO2、H2SO4作用生成G,G中两个取代基处于对位,逆推出C、D、E、F中的两个取代基都处于对位,C的结构简式为
;对比B和C的分子式,B生成C为硝化反应;对比C、D的分子式,C转化为D为C中—Cl被—CN取代;D转化为E发生题给已知①的反应,D中—CN水解成—COOH;E转化为F发生题给已知②的反应,E中—NO2被还原成—NH2;F与NaNO2、H2SO4作用生成G,G中两个取代基处于对位,逆推出C、D、E、F中的两个取代基都处于对位,C的结构简式为![]() ,D的结构简式为
,D的结构简式为![]() ,E的结构简式为
,E的结构简式为![]() ,F的结构简式为
,F的结构简式为![]() ,根据以上推断结果作答。
,根据以上推断结果作答。
A为芳香烃,A与Cl2光照下发生侧链上的取代反应生成B,B的分子式为C7H7Cl,则A为甲苯,A的结构简式为![]() ,B的结构简式为
,B的结构简式为![]() ;对比B和C的分子式,B生成C为硝化反应;对比C、D的分子式,C转化为D为C中—Cl被—CN取代;D转化为E发生题给已知①的反应,D中—CN水解成—COOH;E转化为F发生题给已知②的反应,E中—NO2被还原成—NH2;F与NaNO2、H2SO4作用生成G,G中两个取代基处于对位,逆推出C、D、E、F中的两个取代基都处于对位,C的结构简式为
;对比B和C的分子式,B生成C为硝化反应;对比C、D的分子式,C转化为D为C中—Cl被—CN取代;D转化为E发生题给已知①的反应,D中—CN水解成—COOH;E转化为F发生题给已知②的反应,E中—NO2被还原成—NH2;F与NaNO2、H2SO4作用生成G,G中两个取代基处于对位,逆推出C、D、E、F中的两个取代基都处于对位,C的结构简式为![]() ,D的结构简式为
,D的结构简式为![]() ,E的结构简式为
,E的结构简式为![]() ,F的结构简式为
,F的结构简式为![]() 。
。
(1)A的结构简式为![]() ,A的名称为甲苯。
,A的名称为甲苯。
(2)B→C为硝化反应,反应的试剂是浓硝酸、浓硫酸,反应类型为取代反应(或硝化反应)。E→F为E中—NO2被还原为—NH2,反应类型为还原反应。
(3)C→D的化学方程式为![]() +NaCN→
+NaCN→![]() +NaCl。
+NaCl。
(4)E的结构简式为![]() ,E中含氧官能团的名称为羧基、硝基。
,E中含氧官能团的名称为羧基、硝基。
(5)G的结构简式为![]() ,G中含1个酚羟基和1个羧基,1molG与足量NaOH溶液反应,可以消耗2molNaOH。
,G中含1个酚羟基和1个羧基,1molG与足量NaOH溶液反应,可以消耗2molNaOH。
(6)G中含1个酚羟基和1个羧基,H是G的同系物,H中含1个酚羟基和1个羧基;G的分子式为C8H8O3,H的相对分子质量比G大14,H的分子组成比G多1个“CH2”原子团,H的分子式为C9H10O3;H的苯环上有两个取代基,H的苯环上的两个取代基为:①—OH和—CH2CH2COOH、②—OH和![]() ,苯环上两个取代基有邻、间、对三种位置关系,符合条件的H的同分异构体有2×3=6种;其中核磁共振氢谱有六组峰,峰面积之比为1:2:2:2:2:1的结构简式为
,苯环上两个取代基有邻、间、对三种位置关系,符合条件的H的同分异构体有2×3=6种;其中核磁共振氢谱有六组峰,峰面积之比为1:2:2:2:2:1的结构简式为![]() 。
。
(7)对比![]() 和
和![]() 的结构简式,模仿流程中“B→C”和“E→F→G”,即将
的结构简式,模仿流程中“B→C”和“E→F→G”,即将![]() 先发生硝化反应生成
先发生硝化反应生成![]() ,
,![]() 在Fe/H+作用下发生还原反应生成
在Fe/H+作用下发生还原反应生成![]() ,
,![]() 与NaNO2、H2SO4作用生成
与NaNO2、H2SO4作用生成![]() ;合成路线为:
;合成路线为:![]()
![]()
![]()
![]()
![]()
![]()
![]() 。
。


科目:高中化学 来源: 题型:
【题目】下列说法中,正确的是
A.通过石油分馏可以获得大量的芳香烃
B.石油裂化的目的是为了得到乙烯、丙烯和苯
C.煤的干馏发生了化学变化
D.煤中含有苯和甲苯,可以通过先干馏后分馏的方法得到苯和甲苯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】全钒液流储能电池一次性充电后,续航能力可达1000km,而充电时间只需3~5min,被誉为“完美电池”,其原理如图所示(已知V2+呈紫色,V3+呈绿色)。电池放电时,左槽溶液质量增加。下列说法正确的是

A. 充电时的阴极反应为VO2++2H++e-=VO2++H2O
B. 放电时的正极反应为V3++e-=V2+
C. 放电过程中,右槽溶液由紫色变为绿色
D. 若负载为用石墨电极电解食盐水的装置,生成4gNaOH时该电池中消耗0.1molH+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向100 mL NaOH溶液中通入一定量的CO2气体,充分反应后,再向所得溶液中逐滴加入0.2 mol/L的盐酸,产生CO2的体积与所加盐酸体积之间关系如下图所示。下列判断正确的是( )

A. 原NaOH溶液的浓度为0.1 mol·L-1
B. 通入CO2的体积为448 mL
C. 所得溶液的溶质成分的物质的量之比为n(NaOH)∶n(Na2CO3)=1∶3
D. 所得溶液的溶质成分的物质的量之比为n(NaHCO3)∶n(Na2CO3) = 2∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为探究草酸分解的产物,设计的实验装置如图所示,下列说法正确的是

A. 实验开始时,先点燃A装置处的酒精灯,后点燃F装置处的酒精灯
B. B 装置中的现象为蓝色粉末变白,说明分解产物中有水生成
C. G装置中澄清石灰水变浑浊,说明分解产物中有CO生成
D. C、D、E装置中分别盛放澄清石灰水、浓硫酸、氢氧化钠溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
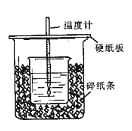
(1)从实验装置上看,图中尚缺少的一种玻璃仪器是 。
(2)烧杯间填满碎纸条的作用是 。
(3)大烧杯上如不盖硬纸板,求得的中和热数值 (填“偏大、偏小、无影响”)
(4)如果用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量 (填“相等、不相等”),所求中和热 (填“相等、不相等”),简述理由
(5)用相同浓度和体积的氨水(NH3·H2O)代替NaOH溶液进行上述实验,测得的中和热的数值会 ;(填“偏大”、“偏小”、“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列信息判断氢气燃烧生成水时的热量变化,其中一定正确的是( )

A. H2O分解为H2与O2时放出热量
B. 生成1mol H2O时吸收热量245 kJ
C. 甲、乙、丙中物质所具有的总能量大小关系为乙>甲>丙
D. 氢气和氧气的总能量小于水的能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】部分氧化的 Fe-Cu 合金样品(氧化物为 Fe2O3、CuO)共5.76 g,经如下处理:

下列说法正确的是( )
A. 滤液A中的阳离子为Fe2+、Fe3+、H+ B. 溶解样品消耗的硫酸共为 0.04 mol
C. 样品中氧元素的质量为 0.48 g D. V=336 mL
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com