
��¯������ұ��������Ҫ��������������Ҫ��ӦΪ��
Fe2O3(s)+3CO(g)  2Fe(s)+3CO2(g) ��H =" a" kJ mol��1
2Fe(s)+3CO2(g) ��H =" a" kJ mol��1
��1����֪�� ��Fe2O3(s)+3C(ʯī) = 2Fe(s)+3CO(g) ��H1 =" +" 489.0 kJ mol��1
��C(ʯī)+CO2(g) = 2CO(g) ��H2 =" +" 172.5 kJ mol��1
��a = kJ mol��1��
��2��ұ������Ӧ��ƽ�ⳣ������ʽK = ���¶����ߺ�Kֵ ������������䡱��С������
��3����T��ʱ���÷�Ӧ��ƽ�ⳣ��K=64����2L�����ܱ����������У��ֱ��±���ʾ�������ʣ���Ӧ����һ��ʱ���ﵽƽ�⡣
| | Fe2O3 | CO | Fe | CO2 |
| ��/mol | 1.0 | 1.0 | 1.0 | 1.0 |
| ��/mol | 1.0 | 2.0 | 1.0 | 1.0 |
��1��a=" -28.5" kJ mol��1 (2��)
��2��K =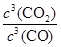 (1��) ��С (1��)
(1��) ��С (1��)
��3����60 % (2��) ��ac (2��)
��4����bc (2��) ��п (�𰸺���������) (2��)
���������������1�����ݸ�˹���ɣ�a=?H1-3?H2=" -28.5" kJ mol��1
��2����Ϊֻ��CO��CO2Ϊ���壬���ԣ�2��K =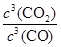
��Ϊ�÷�ӦΪ���ȷ�Ӧ�������¶����ߺ�ƽ�������ƶ���Kֵ��С��
��3�������������CO��ƽ��ת����Ϊa����������ʽ���м���
Fe2O3(s)+3CO(g)  2Fe(s)+3CO2(g)
2Fe(s)+3CO2(g)
��ʼŨ�ȣ�mol?L?1�� 0.5 0.5
ת��Ũ�ȣ�mol?L?1�� 0.5a 0.5a
ƽ��Ũ�ȣ�mol?L?1�� 0.5-0.5a 0.5+0.5a
K=��0.5+0.5a��3 �£� 0.5-0.5a��3=64���ɵ�a=60%
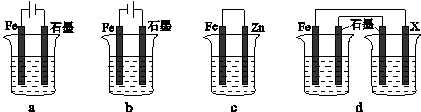
�� a����Ӧǰ�����������仯��������䣬�������������ܶȺ㶨ʱ����־��Ӧ�ﵽƽ��״̬����ȷ��b����������һ����̼���ӣ��൱������ѹǿ����Ӧǰ��������䣬��������CO��ƽ��ת���ʵ����ҵ�ת���ʣ�����c����������ƽ��һ����̼���ʵ���Ϊ0.4mol���������н��ƽ�ⳣ������õ�����һ����̼Ϊ1.4mol��ƽ�����ʵ���Ϊ0.6mol������������CO��ƽ��Ũ��֮��Ϊ0.4+0.6=2��3����ȷ��d�����������Ӳ�Ӱ�컯ѧƽ�⣬����Fe2O3�������CO��ת���ʣ�����
��4����װ����ԭ��ص������͵��ص��������Եõ�������bc���Ա��������ʴ�Ϊ��bc��
��װ��Ϊԭ��أ�����dװ�ñ�������X���ĵ缫����Ӧ�������ÿ���ѡ��п��
���㣺���⿼���Ȼ�ѧ����ʽ��˹���ɼ���Ӧ�á�ƽ�ⳣ������Ӧ�á���ѧƽ������ʽ��ʽ���㷽����ԭ���ԭ���ķ����жϡ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��10 L���ܱ������У��������»�ѧ��Ӧ��CO2��g����H2��g�� CO��g����H2O��g���仯ѧƽ�ⳣ��K���¶�t�Ĺ�ϵ���±���
CO��g����H2O��g���仯ѧƽ�ⳣ��K���¶�t�Ĺ�ϵ���±���
| t/�� | 700 | 800 | 830 | 1 000 | 1 200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�̶�������CO2����Ч��������Դ�������ٿ����е��������塣��ҵ����һ����CO�������״�ȼ�ϵķ����� CO2(g)��3H2(g) CH3OH(g)��H2O(g) ��H �� ��49.0 kJ��mol��1��
CH3OH(g)��H2O(g) ��H �� ��49.0 kJ��mol��1��
ij��ѧʵ�齫6molCO2��8molH2����2L���ܱ������У����H2�����ʵ�����ʱ��仯����ͼ��ʾ��ʵ�ߣ���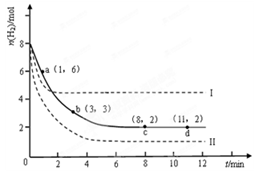
��1��a������Ӧ����_______������ڡ����ڻ�С�ڣ��淴Ӧ���ʡ�
��2������ʱ���ƽ����Ӧ����������__________��
| A��0��1min | B��1��3min | C��3��8min | D��8��11min |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�ϳɰ������Ĵ����������˹��̵�����Ҫ;�������о�������ȷ������ָ�����ϳɰ���Ӧ��ƽ�ⳣ��Kֵ���¶ȵĹ�ϵ���£�
| �� �ȣ��棩 | 360 | 440 | 520 |
| Kֵ | 0.036 | 0.010 | 0.0038 |
 CO(g) + 3H2(g) ��ȡ����֪�÷�Ӧ�У�����ʼ������е�
CO(g) + 3H2(g) ��ȡ����֪�÷�Ӧ�У�����ʼ������е�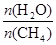 �㶨ʱ���¶ȡ�ѹǿ��ƽ������CH4������Ӱ������ͼ��ʾ��
�㶨ʱ���¶ȡ�ѹǿ��ƽ������CH4������Ӱ������ͼ��ʾ��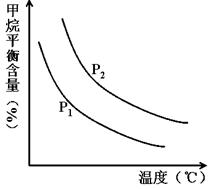
 CO2 (g) + H2(g) ��ȡ��
CO2 (g) + H2(g) ��ȡ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
���ж������������N2O5��һ�������������������ʺ��Ʊ��յ����ǵĹ�ע��
��1��һ���¶��£��ں����ܱ�������N2O5�ɷ������з�Ӧ��2N2O5(g) 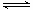 4NO2(g)��O2(g) ���SH��0
4NO2(g)��O2(g) ���SH��0
�ٷ�Ӧ�ﵽƽ�������ͨ��һ�����������N2O5��ת���ʽ�___�����������С���������䡱����
���±�Ϊ��Ӧ��T1�¶��µIJ���ʵ�����ݣ�
| t/s | 0 | 500 | 1000 |
| c(N2O5)/mol��L��1 | 5.00 | 3.52 | 2.48 |
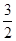 ��(������NO2�ۺϳ�N2O4)����N2O5��ת����a1�� �����¶��·�Ӧ��ƽ�ⳣ��K��_______��
��(������NO2�ۺϳ�N2O4)����N2O5��ת����a1�� �����¶��·�Ӧ��ƽ�ⳣ��K��_______��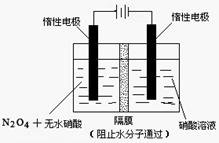
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��֪2NO2(g) N2O4(g) ��H= -52.7kJ��mol-1��ij����С��Ϊ��̽���¶Ⱥ�ѹǿ�Ի�ѧƽ���Ӱ�죬������������ʵ�飺
N2O4(g) ��H= -52.7kJ��mol-1��ij����С��Ϊ��̽���¶Ⱥ�ѹǿ�Ի�ѧƽ���Ӱ�죬������������ʵ�飺
��.��С���ͬѧȡ��������ƿA��B���ֱ������ͬŨ�ȵ�NO2��N2O4�Ļ�����壬�м��ü��Ӽн��� ����A��B���뵽��ʢ��ˮ�������ձ��У���ͼ��ʾ����Ȼ��ֱ��������ձ��м���Ũ�����NH4NO3���塣��ش������й�����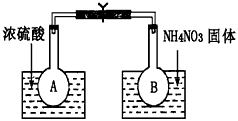
��1���۲쵽��ʵ������Ϊ��_____________________________
��2����ʵ�������֪�������¶ȣ��û�ѧƽ����___________����������桱����Ӧ�����ƶ�����Ӧ��NO2��ת���ʽ�_______________�����������С�����䡱����
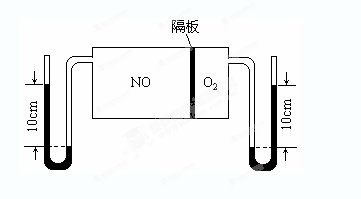
��.����֧�ݻ���Ϊ30mL��Ͳ�зֱ����10mLNO2���壬����Ͳǰ�˷�ա�ʵ������е�һ֧��Ͳ�����κβ���������Ϊʵ������۲�ʱ�IJ��ն���
��3��ijͬѧ���ڶ�֧��Ͳ����Ѹ������5mL������ʱ�������ɫ���һ��ʱ���������ɫ�ֱ�dz�ˡ��Խ���һ��ʱ���������ɫ�ֱ�dz��ԭ��________________________��
��4��ijͬѧ������֧��Ͳ����Ѹ������20mL����
�ٸ�ͬѧ�۲쵽�������ǣ�__________________________
���ڴ˹����У��÷�Ӧ�Ļ�ѧƽ�ⳣ����______________(���������С�����䡱����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
(1)��ѧƽ�ⳣ��K��ʾ���淴Ӧ�Ľ��г̶ȣ�KֵԽ��ʾ_____________��Kֵ��С���¶ȵĹ�ϵ�ǣ��¶����ߣ�Kֵ______________(�һ��������һ����С������������Ҳ���ܼ�С��)��
��2����һ���Ϊ10L�������У�ͨ��һ������CO��H2O����850��ʱ�������·�Ӧ��CO(g)ʮH2O(g) 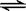 CO2(g)ʮH2 (g) ��H < 0 ��CO��H2OŨ�ȱ仯����ͼ���� 0��4min��ƽ����Ӧ����v(CO)��______ mol��(L��min)
CO2(g)ʮH2 (g) ��H < 0 ��CO��H2OŨ�ȱ仯����ͼ���� 0��4min��ƽ����Ӧ����v(CO)��______ mol��(L��min)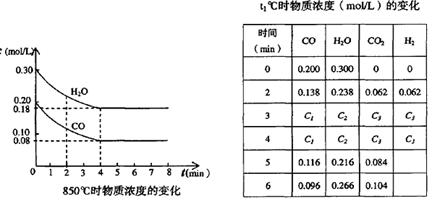
��3��t��(����850��)ʱ������ͬ�����з���������Ӧ�������ڸ����ʵ�Ũ�ȱ仯���ϱ���
�ٱ���3min��4min֮�䷴Ӧ����_________״̬�� C1��ֵ_________0.08 mol��L (����ڡ�С�ڻ����)��
�ڷ�Ӧ��4min��5min�ʣ�ƽ�����淽���ƶ������ܵ�ԭ����________(��ѡ)�� ����5min��6min֮����ֵ�����仯�����ܵ�ԭ����__________(��ѡ)��
| A������ˮ���� | B�������¶� |
| C��ʹ�ô��� | D����������Ũ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�����Ϊ2 L���ܱ������У��������»�ѧ��Ӧ��CO2(g)��H2(g) CO(g)��H2O(g) ��H=Q����ѧƽ�ⳣ��K���¶�T�Ĺ�ϵ���±���
CO(g)��H2O(g) ��H=Q����ѧƽ�ⳣ��K���¶�T�Ĺ�ϵ���±���
| T/�� | 700 | 800 | 850 | 1 000 | 1 200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��Դ��ȱ������������ٵ��ش����⡣�״���һ�ֿ�������Դ�����й㷺�Ŀ�����Ӧ��ǰ������ҵ�Ϻϳɼ״��ķ�ӦΪ��CO(g)��2H2(g) CH3OH(g)����H
CH3OH(g)����H
��1����֪���÷�Ӧ��300�棬5MPa���������Է����У���H 0����S 0���������������
��2����300�棬5MPa�����£���0.20mol�� CO��0.58mol H2�Ļ���������2L�ܱ�����������Ӧ����Ӧ�����м״������ʵ���Ũ����ʱ��ı仯��ͼ��ʾ��
����0��2min�ڣ���H2��ʾ��ƽ����Ӧ����Ϊ mol��L-1��s-1 ��CO��ת����Ϊ ��
����ʽ����300��ʱ�÷�Ӧ��ƽ�ⳣ��K�� ��
��300��ʱ����0.50mol CO��1.00mol H2��1.00 mol CH3OH�����ݻ�Ϊ2L���ܱ������У���ʱ��Ӧ�� ��
A�����������ƶ� B�����淽���ƶ� C������ƽ��״̬ D�����ж�
�����д�ʩ�����Ӽ״����ʵ��� ��
A��ѹ��������� B����CH3OH(g)����ϵ�з���
C������He��ʹ��ϵ��ѹǿ���� D���ٳ���0.20mol CO��0.58mol H2
��3���������������䣬ʹ��Ӧ��500���½��У���ͼ�������״������ʵ���Ũ����ʱ��ı仯��ʾ��ͼ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com