
合成氨技术的创立开辟了人工固氮的重要途径,其研究来自正确的理论指导,合成氨反应的平衡常数K值和温度的关系如下:
| 温 度(℃) | 360 | 440 | 520 |
| K值 | 0.036 | 0.010 | 0.0038 |
 CO(g) + 3H2(g) 获取,已知该反应中,当初始混合气中的
CO(g) + 3H2(g) 获取,已知该反应中,当初始混合气中的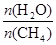 恒定时,温度、压强对平衡混合气CH4含量的影响如下图所示:
恒定时,温度、压强对平衡混合气CH4含量的影响如下图所示: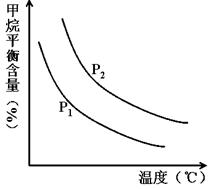
 CO2 (g) + H2(g) 获取。
CO2 (g) + H2(g) 获取。(1)①N2 + 3H2 2 NH3(2分) ② 随温度升高,反应的平衡常数K减小(2分)
2 NH3(2分) ② 随温度升高,反应的平衡常数K减小(2分)
③a、d(2分) (2)①<(2分)②吸热(2分)
(3)①60 %(2分) 9/4或2.25(2分) ②c和d(2分)
解析试题分析:(1)①工业上利用氮气和氢气在一定条件下发生化合反应制备氨气,所以工业合成氨的化学方程式为N2 + 3H2 2 NH3。
2 NH3。
②根据表中数据可知,随着温度的逐渐升高,平衡常数逐渐减小。这说明升高温度平衡向逆反应方向移动,因此正方应是放热反应。
③合成氨是体积减小的放热的可逆反应,则a、增大压强,平衡向正反应方向移动,氢气的转化率增大,a正确;b、催化剂只能改变反应速率,而不能改变平衡状态,所以使用合适的催化剂不能改变氢气的转化率,b不正确;c、升高温度,平衡向逆反应方向移动,氢气的转化率降低,c不正确;d、及时分离出产物中的NH3,降低生成物浓度,平衡向正反应方向移动,氢气转化率增大,d正确,答案选ad。
(2)①根据方程式可知正方应是体积增大的可逆反应,因此增大压强平衡向逆反应方向移动,甲烷的平衡含量增大。根据图像可知,在温度相同时P2曲线对应的甲烷含量高,所以压强关系是P1<P2。
②根据图像可知,在压强恒定时,随之温度的升高,甲烷的含量降低。这说明升高温度平衡向正反应方向移动,即正方应是吸热反应。
(3)① CO(g) + H2O(g) CO2 (g) + H2(g)
CO2 (g) + H2(g)
起始浓度(mol/L) 0.2 0.2 0 0
转化浓度(mol/L) 0.12 0.12 0.12 0.12
平衡浓度(mol/L) 0.08 0.08 0.12 0.12
所以根据化学平衡常数是在一定条件下,当可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值可知,该温度下平衡常数K= =
=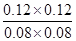 =
=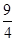 。
。
平衡时CO的转化率= ×100%=60%。
×100%=60%。
②在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态,据此可以判断。A、该反应是体积不变的可逆反应,因此反应前后压强始终是不变,所以容器内压强不随时间改变不能说明反应达到平衡状态,a不正确;b、密度是混合气的质量和容器容积的比值,在反应过程中质量和容积始终是不变的,即密度始终是不变的,所以混合气体的密度不随时间改变不能说明反应达到平衡状态,b不正确;c、单位时间内生成a mol CO2的同时必然同时生成amol氢气,又因为消耗a mol H2,这说明正逆反应速率相等,反应达到平衡状态,c正确;d、混合气中n(CO) : n(H2O) : n(CO2) : n(H2) = 1: 16 : 6 : 6,此时Q= =
= =
=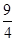 ,所以反应达到平衡状态,d正确,答案选cd。
,所以反应达到平衡状态,d正确,答案选cd。
考点:考查外界条件对平衡状态的影响、平衡状态判断、平衡常数以及转化率的有关计算


 字词句段篇系列答案
字词句段篇系列答案科目:高中化学 来源: 题型:填空题
镍具有优良的物理和化学特性,是许多领域尤其是高技术产业的重要原料。羰基法提纯粗镍涉及的两步反应依次为:
①Ni(s)+4CO(g)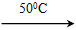 Ni(CO)4(g)+Q
Ni(CO)4(g)+Q
②Ni(CO)4(g)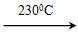 Ni(s)+4CO(g)
Ni(s)+4CO(g)
完成下列填空:
(1)在温度不变的情况下,要提高反应①中Ni(CO)4的产率,可采取的措施有____________、____________ 。
(2)若反应②达到平衡后,保持其他条件不变,降低温度,重新达到平衡时_______________ 。
a.平衡常数K增大 b.CO的浓度减小
c.Ni的质量减小 d.v逆[Ni(CO)4]增大
(3)简述羰基法提纯粗镍的操作过程____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
在2L密闭容器内,800℃时反应:2NO(g)+O2(g)  2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
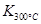 >
>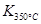 ,则该反应是 热反应。
,则该反应是 热反应。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
t℃时,将3 mol A和1 mol B气体通人体积为2L的密闭容器中(容积不变),发生如下反应:3A(g)+B(g) xC(g),2min时反应达到平衡状态(温度不变),剩余了0.8 mol B,并测得C的浓度为0.4 mol/L,请填写下列空白:
xC(g),2min时反应达到平衡状态(温度不变),剩余了0.8 mol B,并测得C的浓度为0.4 mol/L,请填写下列空白:
(1)从开始反应至达到平衡状态,生成C的平均反应速率为 ;
(2)x= ;
(3)若向原平衡混合物的容器中再充人a mol C,在t℃时达到新的平衡,此时B的物质的量为n(B)= mol;
(4)如果上述反应在相同温度和容器中进行,欲使反应达到平衡时C的物质的量分数与原平衡相等,起始加入的三种物质的物质的量n(A)、n(B)、n(C)之间应该满足的关系式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某温度下,将2mol A和2.8 mol B充入体积为2 L的恒容密闭容器中,发生如下反应:
aA(g)+B(g) 2C(g)+ D(s) ,5 min后达到平衡。平衡时A为1.6mol,放出的热量为Q。在t0时刻,若从平衡体系中分离出四分之一的混合气体,新平衡体系中c(A)为0.6mol/L。
2C(g)+ D(s) ,5 min后达到平衡。平衡时A为1.6mol,放出的热量为Q。在t0时刻,若从平衡体系中分离出四分之一的混合气体,新平衡体系中c(A)为0.6mol/L。
(1) 5 min内用B表示该反应的化学反应速率为 。
(2)该温度下,此可逆反应的逆反应的平衡常数为 。
(3)a的值为 。
(4)下列说法一定能说明上述反应已达到平衡状态的是 。
①单位时间里每生成1molB的同时消耗了2mol的C ②D的物质的量不再变化
③混合气体的密度不再变化 ④混合气体的平均相对分子质量不再变化
⑤体系的压强不再变化
(5)该温度下,某同学设计了以下实验,请在空格中填入热量(含Q的表达式表示)
| 起始 n(A)/mol | 起始 n(B)/mol | 起始 n(C)/mol | 起始 n(D)/mol | 达到平衡时放出(或吸收)的热量 |
| 0 | 1.6 | 8 | 足量 | |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
Ⅰ.在体积恒定的密闭容器中,充入2mol CO2和5mol H2,一定条件下发生反应: CO2(g) + 3H2(g)  CH3OH(g) + H2O(g) △H =" -49.0" kJ/mol。测得CO2和CH3OH(g)的浓度随时间变化如图所示:
CH3OH(g) + H2O(g) △H =" -49.0" kJ/mol。测得CO2和CH3OH(g)的浓度随时间变化如图所示: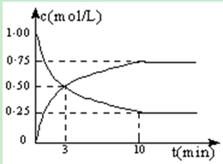
(1)从反应开始到第10min,H2的转化率为 ,在 该条件下,反应的平衡常数K= ,如果在某一时刻保持温度不变,只改变浓度,使c(CO2)=1.00mol/L,c(H2)=0.40mol/L,c(CH3OH)=c(H2O)=0.80mol/L,则平衡 (选填序号)。
a.向正向移动 b.向逆向移动
c.不移动 d.无法确定平衡移动方向
(2)下列措施中能使n(CH3OH)/n(CO2)增大的是 (选填序号)。
a.升高温度 b.充入He(g),使体系压强增大
c.将H2O(g)从体系中分离 d.再充入l mol CH3OH(g)
II.熔融碳酸盐燃料电池(MCFS),发明于1889年。现有一个碳酸盐燃料电池,以一定比例Li2CO3和Na2CO3低熔混合物为电解质,操作温度为650℃,在此温度下以镍为催化剂,以煤气(CO、H2的体积比为1:1)直接作燃料,其工作原理如图所示。请回答下列问题:
(1)A电极的电极反应方程式为 。
(2)常温下,用石墨作电极,以此电源电解一定量的CuSO4 溶液。当两极产生的气体体积相同时停止通电,若电解后溶液的体积为2L,溶液的pH=1(不考虑水解产生的H+),则阳极产生的气体的物质的量是 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
高炉炼铁是冶炼铁的主要方法,发生的主要反应为:
Fe2O3(s)+3CO(g)  2Fe(s)+3CO2(g) ΔH =" a" kJ mol-1
2Fe(s)+3CO2(g) ΔH =" a" kJ mol-1
(1)已知: ①Fe2O3(s)+3C(石墨) = 2Fe(s)+3CO(g) ΔH1 =" +" 489.0 kJ mol-1
②C(石墨)+CO2(g) = 2CO(g) ΔH2 =" +" 172.5 kJ mol-1
则a = kJ mol-1。
(2)冶炼铁反应的平衡常数表达式K = ,温度升高后,K值 (填“增大”、“不变”或“减小”)。
(3)在T℃时,该反应的平衡常数K=64,在2L恒容密闭容器甲和乙中,分别按下表所示加入物质,反应经过一段时间后达到平衡。
| | Fe2O3 | CO | Fe | CO2 |
| 甲/mol | 1.0 | 1.0 | 1.0 | 1.0 |
| 乙/mol | 1.0 | 2.0 | 1.0 | 1.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
一定温度下2L的恒容容器甲中,加入2moL碳和2moLCO2发生如下反应: C(s)+CO2(g)  2CO(g) △H>0
2CO(g) △H>0
测得容器中CO2的物质的量随时间t的变化关系如图所示。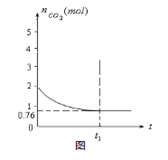
(1)该反应的ΔS 0(填“>”、“<”或“=”)。在 (填“较高”或“较低”) 温度下有利于该反应自发进行。
(2)列式并计算上述温度下此反应的平衡常数K 。(结果保留一位小数)
(3)向上述平衡体系中再通入CO2,则CO2的转化率 (填增大、减小、不变、无法确定)。
(4)相同温度下,2L的恒容容器丙中加入4moL碳、4moLCO2和4moLCO。开始反应时v(正) v(逆)(填>、 <、﹦)。
(5)相同温度下,2L的恒容容器乙中加入4moL碳和4moLCO2,达到平衡。请在图中画出乙容器中CO2的物质的量随时间t变化关系的预期结果示意图。(注明平衡时CO2的物质的量)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com