
| A. | 酸性氧化物、非金属氧化物 | B. | 胶体、分散系 | ||
| C. | 含氧酸、酸 | D. | 化合物、非电解质 |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁粉溶解,没有任何金属生成 | B. | 铁粉未完全溶解 | ||
| C. | 析出0.1mol 银和0.1mol 铜 | D. | 析出0.1mol 银和0.05mol 铜 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
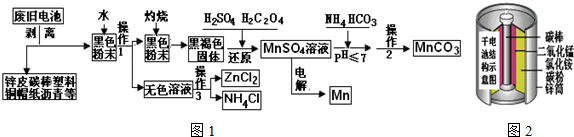
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3OH的燃烧热为192.9 kJ•mol-1 | |
| B. | CH3OH的燃烧热为676.7 kJ•mol-1 | |
| C. | CH3OH转变成H2的过程一定要吸收能量 | |
| D. | 根据②推知反应:CH3OH(l)+$\frac{1}{2}$O2(g)═CO2(g)+2H2(g)的△H>-192.9kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 液氧、稀硫酸、氨气 | B. | 干冰、氢氧化镁、氢氧化铁胶体 | ||
| C. | 冰、氯化钠固体、乙醇 | D. | 生石灰、熟石灰、石灰石 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl2+2NaOH═NaCl+NaClO+H2O | B. | Fe+CuSO4═FeSO4+Cu | ||
| C. | 2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑ | D. | 2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下2.2gCO2中含有共用电子对的数目为2NA | |
| B. | 标准状况下,11.2L苯中含的碳原子数为3NA | |
| C. | 25℃时,0.1mol/L的一元强酸HA中,H+的个数为0.1NA | |
| D. | 6.4gCu与一定浓度的HNO3完全反应得到混合气体,则反应转移的电子数为0.2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com