
| A、SO3的分解率为20% |
| B、10分钟内ν(SO2)=0.01mol/(L?min) |
| C、容器内气体的密度为40g/L |
| D、加压,容器内固体的质量不变 |
| 0.1 |
| 0.5 |
| 0.05mol/L |
| 10min |
| 0.4mol/L×1L×80g/mol+0.1mol/L×1L×64g/mol+0.05mol/L×1L×32g/mol |
| 1L |


 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:
| +水 |
| 消去 |
| 催化氧化 |
| A、A是乙炔,B是乙醇 |
| B、A是乙烯,C是乙醛 |
| C、A是乙烯,C是乙醇 |
| D、A是环己烷,C是苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验组别 | ① | ② | ③ | ④ | ⑤ |
| 加入样品的质量/g | 1.0 | 1.0 | 1.0 | 1.0 | 1.0 |
| 加入0.2mol/L稀盐酸的体积/mL | 20.0 | 40.0 | 60.0 | 80.0 | 100.0 |
| 充分反应后生成标准状况下气体的体积/mL | 44.8 | 89.6 | 134.4 | 179.2 | 179.2 |
| A、20% | B、40% |
| C、60% | D、80% |
查看答案和解析>>
科目:高中化学 来源: 题型:
| X | Y | ||
| Z | W |
| A、Z的气态氢化物比W的气态氢化物稳定 |
| B、原子半径由大到小的顺序为:X>Y |
| C、X元素只能形成一种单质 |
| D、Y元素可形成多种氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 电离能/kJ?mol-1 | I1 | I2 | I3 | I4 | I5 |
| Y | 584 | 1823 | 2751 | 11584 | 14837 |
查看答案和解析>>
科目:高中化学 来源: 题型:
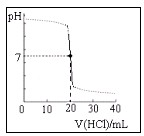 用某浓度的HCl溶液滴定某浓度的NaOH溶液25.00ml,滴定曲线如图所示.则HCl溶液与NaOH溶液的物质的量浓度可能是(单位:mol/L)( )
用某浓度的HCl溶液滴定某浓度的NaOH溶液25.00ml,滴定曲线如图所示.则HCl溶液与NaOH溶液的物质的量浓度可能是(单位:mol/L)( )| A | B | C | D | |
| HCl | 0.12 | 0.10 | 0.10 | 0.08 |
| NaOH | 0.10 | 0.12 | 0.08 | 0.10 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com