
元素符号 | Li | Na | K | Rb | Cs |
原子结构 示意图 |
|
|
|
|
|
原子半径 变化趋势 | 原子半径越来越____________ | ||||
原子核对核外电子的吸引力的变 化趋势 | 原子核对核外电子的吸引力越来越_____________ | ||||
原子失 电子难易 | 原子失电子越来越_____________ | ||||
元素金属 性强弱 | 元素的金属性越来越_____________ | ||||
单质物理性质变化趋势 | 密度逐渐_________,熔点逐渐_________,硬度逐渐________ | ||||
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
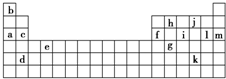 下表是周期表的一部分,表中所列的字母分别代表某一化学元素.
下表是周期表的一部分,表中所列的字母分别代表某一化学元素.| 锂 | X | Y | |
| 失去第一个电子 | 519 | 502 | 580 |
| 失去第二个电子 | 7 296 | 4 570 | 1 820 |
| 失去第三个电子 | 11 799 | 6 920 | 2 750 |
| 失去第四个电子 | 9 550 | 11 600 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 锂 | X | Y | |
| 失去第一个电子 | 519 | 502 | 580 |
| 失去第二个电子 | 7 296 | 4 570 | 1 820 |
| 失去第三个电子 | 11 799 | 6 920 | 2 750 |
| 失去第四个电子 | 9 550 | 11 600 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 元素编号 元素性质 |
① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ |
| 原子半径(10-10m) | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 |
| 最高增化合价 | +2 | +1 | +5 | +7 | +1 | +5 | |
| 最低化合价 | -2 | -3 | -1 | -3 |
| ||
| ||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com