
下列解释实验事实的方程式正确的是
A.氨水中滴入酚酞溶液,溶液变红:
NH3·H2O  NH4+ + OH—
NH4+ + OH—
B.90℃时,测得纯水中c(H+)·c(OH—) =3.8×10—13:
H2O(l)  H+(aq) + OH—(aq)
H+(aq) + OH—(aq)  H<0
H<0
C.FeCl3溶液中通入SO2,溶液黄色褪去:
2Fe3++SO2 +2H2O  2Fe2+ + SO42—+ 4H+
2Fe2+ + SO42—+ 4H+
D.向苯酚钠溶液中通入CO2,溶液变浑浊:
2C6H5ONa+CO2+H2O → 2C6H5OH+Na2CO3
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
下列各组反应最终有白色沉淀生成的是( )
①金属钠投入到FeCl2溶液中 ②过量NaOH溶液和AlCl3溶液混合
③少量Ca(OH)2投入NaHCO3溶液中 ④过量CO2通入NaAlO2溶液中
A.②③ B.③④ C.①③④ D.①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
氢溴酸在医药和石化工业上有广泛用途。下图是模拟工业制备氢溴酸粗品并精制的流程:

根据上述流程回答下列问题:
(1)混合①中发生反应的化学方程式为______________________________________。
(2)混合①中使用冰水的目的是___________ ______________________。
(3)操作Ⅱ和Ⅲ的名称分别是________、__________。操作Ⅲ一般适用于分离_______混合物(选填编号)。
a.固体和液体 b.固体和固体
c.互不相溶的液体 d.互溶的液体
(4)混合②中加入Na2SO3的目的是____________________________________________。
(5)纯净的氢溴酸应为无色液体,但实际工业生产中制得的氢溴酸(工业氢溴酸)常带有淡淡的黄色。于是甲、乙两同学设计了简单实验加以探究:甲同学假设工业氢溴酸呈淡黄色是因为含Fe3+,则用于证明该假设所用的试剂为____________,若假设成立可观察到的现象为____________________________。乙同学假设工业氢溴酸呈淡黄色是因为_____________________________,其用于证明该假设所用的试剂为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室里不同化学试剂的保存方法不尽相同,①NaOH溶液 ②大理石 ③NaCl溶液 ④硝酸4种试剂通常各自存放在如下图所示的玻璃试剂瓶中。按照试剂瓶的顺序存放试剂序号正确的是
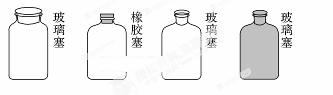
A.①②③④ B.②①④③
C.②③④① D.②①③④
查看答案和解析>>
科目:高中化学 来源: 题型:
长期存放的Na2SO3可能部分被氧化。某化学兴趣小组为了测定某无 水Na2SO3被氧化的程度,进行如下实验:
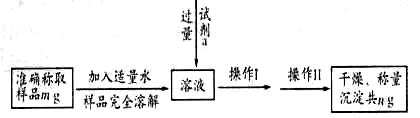 (1) 甲同学设计如下实验流程:
(1) 甲同学设计如下实验流程:
①甲同学选择的试剂a可以是________(填序号)。
A.盐酸酸化后的氯化钡 B.硝酸酸化后的氯化钡 C.氢氧化钡
②判断试剂a是否过量的方法是__________________
③操作II名称是________________________
④Na2SO3的质量分数的表达式为__________________
(2)乙同学准确称量Na2SO3样品mg,并设计如下图所示的实验装置,进行相关实验:
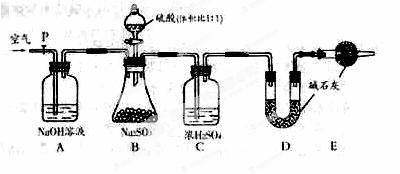
①实验中待锥形瓶中不再产生气体后,打开活塞P从导管左端缓缓鼓入一定量的 空气,这样做的目的是____________________________________。
②装置B中发生反应的化学方程式为:_________________________。
③装置C的作用是_________________________________。
④若实验前后装置D的质量差为ng,则样品中Na2SO3的质量分数的表达式_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
人体血液中存在平衡: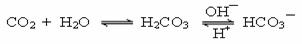 ,使血液pH保持在7.35~7.45之间,否则就会发生酸中毒或碱中毒。已知pH随c(HCO3—)︰c(H2CO3) 变化关系如下表所示,则下列说法中不正确的是
,使血液pH保持在7.35~7.45之间,否则就会发生酸中毒或碱中毒。已知pH随c(HCO3—)︰c(H2CO3) 变化关系如下表所示,则下列说法中不正确的是
| c(HCO3—)︰c(H2CO3) | 1.0 | 17.8 | 20.0 | 22.4 |
| pH | 6.10 | 7.35 | 7.40 | 7.45 |
A.pH=7的血液中,c(HCO3—) > c(H2CO3)
B.人体发生酸中毒时,可静脉滴注一定浓度的NaHCO3溶液解毒
C.常温下将pH=7.40的血液稀释至pH=7时,c(H+)·c(OH—)一定不变
D.c(HCO3—)︰c(H2CO3)=1时,H2CO3的电离程度小于HCO3—的水解程度
查看答案和解析>>
科目:高中化学 来源: 题型:
下列事故处理不正确的是( )
A.不慎碰倒酒精灯,洒出的酒精在桌上燃烧时,应立即用湿抹布扑盖
B.将一氧化碳中毒者移到通风处抢救
C.眼睛里不慎溅进了药液,应立即用水冲洗,边洗边眨眼睛,不可用手揉眼睛
D.不慎将浓硫酸溅到皮肤上,应立即用水冲洗
查看答案和解析>>
科目:高中化学 来源: 题型:
在标准状况下①6.72L CH4 ②3.01×1023个HCl分子 ③13.6g H2S ④0.2mol NH3, 下列对这四种气体的关系从大到小表达正确的是 ( )
a.体积②>③>①>④ b.密度②>③>④>①
c.质量②>③>①>④ d.氢原子个数①>③>④>②
A.abc B.bcd C.abcd D.cba
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com