
长期存放的Na2SO3可能部分被氧化。某化学兴趣小组为了测定某无 水Na2SO3被氧化的程度,进行如下实验:
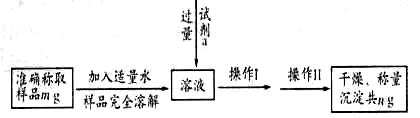 (1) 甲同学设计如下实验流程:
(1) 甲同学设计如下实验流程:
①甲同学选择的试剂a可以是________(填序号)。
A.盐酸酸化后的氯化钡 B.硝酸酸化后的氯化钡 C.氢氧化钡
②判断试剂a是否过量的方法是__________________
③操作II名称是________________________
④Na2SO3的质量分数的表达式为__________________
(2)乙同学准确称量Na2SO3样品mg,并设计如下图所示的实验装置,进行相关实验:
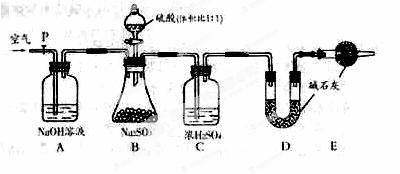
①实验中待锥形瓶中不再产生气体后,打开活塞P从导管左端缓缓鼓入一定量的 空气,这样做的目的是____________________________________。
②装置B中发生反应的化学方程式为:_________________________。
③装置C的作用是_________________________________。
④若实验前后装置D的质量差为ng,则样品中Na2SO3的质量分数的表达式_______________。
科目:高中化学 来源: 题型:
根据砷元素的原子结构示意图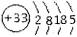 ,做出如下推理,其中与事实不符的是( )
,做出如下推理,其中与事实不符的是( )
A.砷元素位于元素周期的第四周期、第VA族
B.砷原子不如溴原子的得电子能力强
C.砷酸酸性比磷酸酸性强
D.在相同条件砷元素的氢化物的稳定性弱于氨气
查看答案和解析>>
科目:高中化学 来源: 题型:
对于反应KCl03+ HCl = KC1 + Cl2 ↑+ H20(未配平)若有0.1 mol KCl03 参加反应,下列说法正确的是 ( )
A.转移0.5 mol电子 B.生成0.1 mol Cl2
C.被氧化的HC1为0.6 mol D.Cl2是只是氧化产物不是还原产物
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子在指定溶液中一定能大量共存的是
①加入Al能放出H2的溶液中:Fe2+、Al3+、NO 、Cl-、S2-
、Cl-、S2-
②在pH=11的溶液中:Na+、[Al(OH)4]-、NO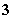 、S2-、SO
、S2-、SO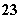
③由水电离的c(H+)=10-12mol·L-1的溶液中:Cl-、HCO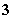 、NO
、NO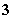 、NH
、NH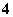 、F-
、F-
④加入Mg能放出H2的溶液中:Mg2+、NH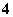 、Cl-、K+、SO
、Cl-、K+、SO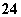
A.②④ B.①②④ C.①③④ D.①②
查看答案和解析>>
科目:高中化学 来源: 题型:
一定量的Fe和Fe2O3混合物投入250ml 2mol/L的HNO3溶液中,反应完全后,无固体剩余,生成1.12L NO气体(标况),再向反应后溶液中加入1 mol/L的NaOH溶液,要使铁元素全部沉淀下来,所加NaOH溶液的体积最少是
A.450ml B.500ml C.400ml D.无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
下列解释实验事实的方程式正确的是
A.氨水中滴入酚酞溶液,溶液变红:
NH3·H2O  NH4+ + OH—
NH4+ + OH—
B.90℃时,测得纯水中c(H+)·c(OH—) =3.8×10—13:
H2O(l)  H+(aq) + OH—(aq)
H+(aq) + OH—(aq)  H<0
H<0
C.FeCl3溶液中通入SO2,溶液黄色褪去:
2Fe3++SO2 +2H2O  2Fe2+ + SO42—+ 4H+
2Fe2+ + SO42—+ 4H+
D.向苯酚钠溶液中通入CO2,溶液变浑浊:
2C6H5ONa+CO2+H2O → 2C6H5OH+Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
硫化物在自然界中的部分循环关系如下。
 |
(1)H2S在空气中可以燃烧。
已知: 2H2S(g) + O2(g)  2S(s) + 2H2O(g) ΔH= -442.38 kJ/mol
2S(s) + 2H2O(g) ΔH= -442.38 kJ/mol
S(s) + O2(g)  SO2(g) ΔH= -297.04 kJ/mol
SO2(g) ΔH= -297.04 kJ/mol
H2S(g)与O2(g)反应产生SO2(g)和H2O(g)的热化学方程式是 。
(2)SO2是大气污染物,海水具有良好的吸收SO2的能力,其过程如下。
① SO2溶于海水生成H2SO3,H2SO3最终会电离出SO32—,其电离方程式是 。
② SO32—可以被海水中的溶解氧氧化为SO42—。海水的pH会 (填“升高” 、“不变”或“降低”)。
③ 为调整海水的pH,可加入新鲜的海水,使其中的HCO3—参与反应,其反应的离子方程式是 。
④ 在上述反应的同时需要大量鼓入空气,其原因是 。
(3)自然界地表层原生铜的硫化物经氧化、淋滤作用后变成CuSO4溶液,向地下深层渗透,遇到难溶的ZnS,慢慢转变为铜蓝(CuS),用化学用语表示由ZnS转变为CuS的过程: 。
(4)SO2和O2在H2SO4溶液中可以构成原电池,其负极反应式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
22.设NA表示阿伏加得德罗常数的数值,下列叙述中正确的是( )
A.标准状况下,22.4LH2O中所含有的氢原子数为2NA
B.常温常压下,22 .4 L氧气所含的原子数为2NA
C.常温常压下,32 g O2所含的氧原子数为2NA
D.在101KPa、25℃条件下,11.2L H2 中含有的原子数目为NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com